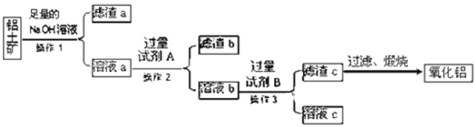
题目内容
【题目】FeSe、MgB2、Nb3Al等超导材料具有广泛应用前景。
(1)Fe2+基态价电子的轨道表示式(价电子排布图)__,Se、Mg、B三种元素的电负性大小顺序是__。
(2)蒸气状态下以二聚分子存在的A1Cl3的结构式是___,其中A1原子的杂化方式是___,分子中八个原子___(选填“是”或“不是”)在同一平面上,该分子是____(选填“极性“或“非极性“)分子。
(3)制备FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2过程中需将金属锂溶于液氨,从而制得具有很高反应活性的金属电子溶液,反应为:Li+(m+n)NH3—X+e-(NH3)n。
①X的化学式为____;
②NH3的价层电子对互斥模型是 ____。
(4)MgB2晶体结构中的B原子层具有类似石墨的层状结构,且被六方密排的Mg原子层隔开,B原子位于Mg原子组成的三棱柱的中心。已知:平面中Mg原子间的最近核间距为acm,平面间Mg原子间的最近核间距为bcm,阿伏加德罗常数为NA。
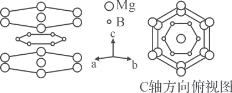
①B原子层六元环中处于对位的B原子核间距为____cm。
②MgB2晶体的密度是____g·cm-3。
【答案】![]() Se>B>Mg
Se>B>Mg ![]() sp3 不是 非极性 Li(NH3)m+ 正四面体形
sp3 不是 非极性 Li(NH3)m+ 正四面体形 ![]() acm
acm ![]()
【解析】
(1)基态Fe2+的电子排布式为1s22s22p63s23p63d6,则Fe2+基态价电子的轨道表示式为![]() ;元素的非金属性越强,电负性越大,而金属性越强,电负性越小,Se的非金属性比B强,Mg为金属,则Se、Mg、B三种元素的电负性大小顺序是Se>B>Mg;
;元素的非金属性越强,电负性越大,而金属性越强,电负性越小,Se的非金属性比B强,Mg为金属,则Se、Mg、B三种元素的电负性大小顺序是Se>B>Mg;
(2)铝原子和氯原子之间形成共价键,还形成一个配位键,其结构为![]() ,氯化铝中每个铝原子含有3个共价键,且不含孤电子对,为平面三角形结构,缔合双分子Al2Cl6中Al原子的轨道杂化类型sp3,则分子中八个原子不是在同一平面上,该分子结构中正负电荷中心重合,为非极性分子;
,氯化铝中每个铝原子含有3个共价键,且不含孤电子对,为平面三角形结构,缔合双分子Al2Cl6中Al原子的轨道杂化类型sp3,则分子中八个原子不是在同一平面上,该分子结构中正负电荷中心重合,为非极性分子;
(3)①根据反应Li+(m+n)NH3—X+e-(NH3)n,结合原子守恒和电荷守恒得X的化学式为Li(NH3)m+;
②NH3分子中N原子形成3个N-H键,还有1对孤电子对,价层电子对数为3+1=4,价层电子对互斥模型为正四面体形;
(4)①Mg原子形成的六元环的中心原子Mg与环上直接相连的两个Mg原子形成等边三角形,边长为acm,则中心Mg原子到棱边的高为![]() acm,则B原子层六元环中处于对位的B原子核间距为等边三角形中心到顶点距离的2倍,即
acm,则B原子层六元环中处于对位的B原子核间距为等边三角形中心到顶点距离的2倍,即![]() acm×
acm×![]() ×2=
×2=![]() acm;
acm;
②晶胞中六元环的面为6个边长为acm的等边三角形,则六边形的面积为6×acm×![]() acm×
acm×![]() =
=![]() a2cm2,则晶胞的体积为
a2cm2,则晶胞的体积为![]() a2cm2×bcm=
a2cm2×bcm=![]() a2bcm3;晶胞中含有Mg原子数为12×
a2bcm3;晶胞中含有Mg原子数为12×![]() +2×
+2×![]() =3,B原子数目为6,则晶胞的质量为
=3,B原子数目为6,则晶胞的质量为![]() g=
g=![]() g,则MgB2晶体的密度是
g,则MgB2晶体的密度是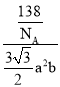 g·cm-3=
g·cm-3=![]() g·cm-3。
g·cm-3。

 备战中考寒假系列答案
备战中考寒假系列答案