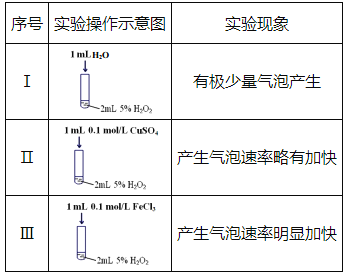
题目内容
【题目】工业废水中常含有一定量的Cr2O72-,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。
(1)利用硫酸工业废气中的SO2 可以处理酸性含铬废水,用离子方程式表示反应原理___________。
(2)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为__________________。
(3)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的酸式电离方程式__________。
(4)Cr3+在强碱中可被双氧水氧化为CrO42-,发生反应的离子方程式为_________________。控制其他条件不变,反应温度对Cr3+转化率的影响如下图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是__________________。

【答案】Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O 6 Cr(OH)3+H2O![]() H++[Cr(OH)4]-[或Cr(OH)3
H++[Cr(OH)4]-[或Cr(OH)3![]() H++CrO2-+H2O] 2Cr3++3H2O2+10OH-=2CrO42-+8H2O 双氧水在较高温度下发生分解,浓度降低
H++CrO2-+H2O] 2Cr3++3H2O2+10OH-=2CrO42-+8H2O 双氧水在较高温度下发生分解,浓度降低
【解析】
(1) SO2具有还原性,能将Cr2O72-转化为Cr3+,用硫酸工业废气中的SO2处理酸性含铬废水,离子方程式为:Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O;(2)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],Ksp[Cr(OH)3]=c(Cr)×c3(OH-)==1×10-6×c3(OH-)=1×10-30,c(OH-)=10-8 mol·L-1,需调节溶液的pH至少为6;(3)由于Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,则Cr(OH)3的酸式电离方程式为:Cr(OH)3+H2O![]() H++[Cr(OH)4]-[或Cr(OH)3
H++[Cr(OH)4]-[或Cr(OH)3![]() H++CrO2-+H2O]; (4)Cr3+在强碱中可被双氧水氧化为CrO42-,发生反应的离子方程式为:2Cr3++3H2O2+10OH-=2CrO42-+8H2O ,双氧水在温度超过70℃时发生分解,浓度降低,氧化能力降低,Cr3+转化率下降。
H++CrO2-+H2O]; (4)Cr3+在强碱中可被双氧水氧化为CrO42-,发生反应的离子方程式为:2Cr3++3H2O2+10OH-=2CrO42-+8H2O ,双氧水在温度超过70℃时发生分解,浓度降低,氧化能力降低,Cr3+转化率下降。

【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:

实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是____________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是_____________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1__________ΔH(填“<”、“>”或“=”),理由是_______________。
【题目】几种短周期元素的原子半径及主要化合价如下表: (请用化学用语答题)
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1) M在元素周期表中的位置为_____________。
(2)X与Y按原子个数比1∶1构成的物质的电子式为____;所含化学键类型______
(3)X+、 Y2-、M2-、R3+离子半径大小顺序为__________。
(4) 写出Z元素气态氢化物的形成过程___________。
(5)将YM2通入FeCl3溶液中的离子方程式:______