题目内容
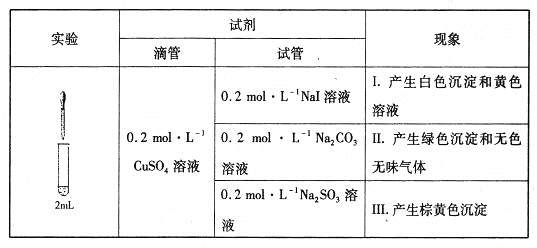
【题目】在水溶液中Fe3+和I-存在可逆反应:2Fe3++2I-![]() 2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
A. 反应的平衡常数K=![]()
B. 该可逆反应只能在酸性条件下存在
C. 加入AgNO3,平衡右移,溶液黄色变浅
D. 加入CCl4,平衡右移,水溶液层黄色变浅
【答案】C
【解析】
平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;Fe3+水解显酸性,在碱性条件下Fe3+和Fe2+以氢氧化物沉淀形式存在;碘单质可以与碱反应生成碘离子和碘酸根离子;银离子与碘离子能生成碘化银沉淀;四氯化碳可以从水溶液中把碘单质萃取出来,以此解答。
A、依据平衡常数含义分析可知,该反应的平衡常数K的表达式为K=![]() ,故A正确;
,故A正确;
B、根据氢氧化铁和氢氧化亚铁的Ksp可知,在碱性条件下,二价铁离子和三价铁离子容易生成沉淀,碘单质易与碱反应生成碘离子和碘酸根离子,而且三价铁离子水解显酸性,为抑制水解且防止生成沉淀或发生反应,该反应应在酸性条件下进行,故B正确;
C、加入硝酸银,银离子与碘离子生成碘化银沉淀,导致平衡左移,故C错误;
D、加入CCl4,I2被萃取到CCl4中,平衡右移,Fe3+和I2的浓度都降低,水溶液层黄色变浅,故D正确。
故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
【题目】解决能源短缺问题,工业生产中应合理利用化学能。
(1)25 ℃、1.01×105 Pa时,实验测得,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则表示H2的燃烧热的热化学方程式为______________________。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H—H | N—H | N≡N |
键能/kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)===2NH3(g) ΔH=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值____________。
(3)已知:C(s,石墨)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)===2H2O(l)ΔH2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)===C2H2(g) ΔH=________。