题目内容
【题目】某研究小组设计了如下实验,探究常温下催化剂对过氧化氢分解反应的影响。
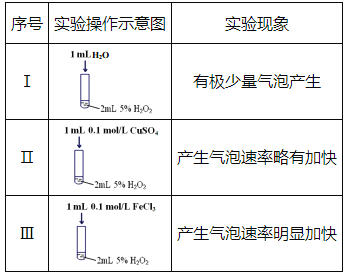
(1)实验I的作用是_________。
(2)实验III中反应的化学方程式为_________。
(3)根据实验I~III中现象的不同,可以得出的结论是:
①使用合适的催化剂,可提高双氧水分解的反应速率;
②___________________________。
(4)在一定温度下,10mL0.40mol/LH2O2溶液发生催化分解,6min后H2O2的浓度减小到0.10mol/L,以H2O2的浓度变化表示的反应速率为v(H2O2)=_________mol/(L·min)。
【答案】对照实验,证明实验II和III中的速率加快与溶液浓度变化无关 2H2O2![]() 2H2O+O2↑ 不同催化剂的催化效率(效果)不同 0.05 mol/(L·min)
2H2O+O2↑ 不同催化剂的催化效率(效果)不同 0.05 mol/(L·min)
【解析】
(1)实验Ⅰ中加入1mL水是让溶液总体积相同,确保双氧水的浓度相同,但没加催化剂,作对照实验;
(2)双氧水分解产生水和氧气,三氯化铁作催化剂;
(3)催化剂具有选择性;
(4)根据v=△c/△t计算得出。
(1)实验Ⅰ中加入1mL水是让溶液总体积相同,确保双氧水的浓度相同,但没加催化剂,与Ⅱ、Ⅲ相同,作对照实验,证明实验Ⅱ和Ⅲ中的速率加快与溶液浓度无关;
(2)双氧水分解产生水和氧气,三氯化铁作催化剂,反应方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(3)根据实验现象可知Ⅱ和Ⅲ在使用不同催化剂时化学反应速率不同,说明催化剂具有选择性,即不同催化剂的催化效率不同;
(4)根据v=△c/△t=(0.40mol·L-1-0.10mol·L-1)/6min=0.05 mol/(L·min)。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大