题目内容
【题目】一定条件下向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,图1表示各物质浓度随时间的变化,图2表示速率随时间的变化。t2、t3、t4、t5时刻后各改变一种条件,且改变条件均不同。若t4时刻改变条件是压强,则下列说法错误的是
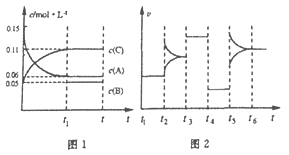
A. 若t1=15s,则前15s的平均反应速率v(C)=0.004mol·L-1·s-1
B. 该反应的化学方程式为:3A(g) ![]() B(g)+2C(g)
B(g)+2C(g)
C. t2、t3、t5时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D. B的起始物质的量为0.04mol
【答案】C
【解析】
A.若t1=15s,生成物C在t0~t1时间段的平均反应速率v=![]() =
=![]() mol/(Ls)=0.004mol/(Ls),A正确;B.反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,则该反应中气体的化学计量数之和前后相等,则有:3A(g)
mol/(Ls)=0.004mol/(Ls),A正确;B.反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,则该反应中气体的化学计量数之和前后相等,则有:3A(g)![]() B(g)+2C(g),B正确;C. t2、t3、t5时刻改变的条件分别是增大反应物浓度、加入催化剂、升高温度,C错误;D.根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为
B(g)+2C(g),B正确;C. t2、t3、t5时刻改变的条件分别是增大反应物浓度、加入催化剂、升高温度,C错误;D.根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为![]() =2L,生成B的物质的量为0.03mol/L×2L=0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol,D正确。答案选C。
=2L,生成B的物质的量为0.03mol/L×2L=0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol,D正确。答案选C。

【题目】在t ℃时,10 L 0.4 mol·L-1 H2O2溶液发生催化分解:2H2O2===2H2O+O2↑,不同时刻测得生成O2的体积如下表,已知反应至6 min时,H2O2分解了50%(已折算为标准状况)
t/min | 0 | 2 | 4 | 6 |
V(O2)/L | 0.0 | 9.9 | 17.2 | V=? |
下列叙述正确的是(溶液体积变化忽略不计)( )
A. 0~2 min H2O2平均反应速率比4~6 min慢
B. 反应至6 min时,共产生O2 44.8 L
C. 0~6 min的平均反应速率v(H2O2)≈3.3×10-2 mol·L-1·min-1
D. 反应至6 min时,c(H2O2)=0.3 mol·L-1
【题目】目前钴酸锂(LiCoO2)锂离子电池应用十分广泛,从废旧钴酸锂理离子电池中回收铝、铁、钴、锂等元素成了重要的研究课题,某小组模拟工业流程从废旧电池中对上述元素进行提取。
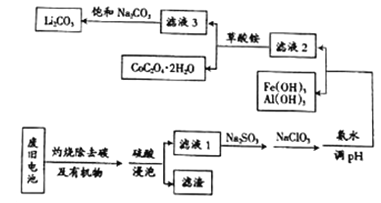
已知:①滤液1中阳离子有H+、CO3+、Fe3+、Al3+、Li+等;
②几种物质不同温度下的溶解度如下表所示:
T/℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)钴酸锂(LiCoO2)中钴元素的化合价是_______________。
(2)上述流程中将CoO2-转化为Co3+的离子方程式为_________________。
(3)滤液1中加入Na2SO3的主要目的是_____________________;加入NaClO3的主要目的是____________。
(4)为了使Fe3+、Al3+沉淀完全(通常认为金属离子浓度小于或等于10-5mol·L-1时表示已沉淀完全)加入氨水调节pH的最小值是____________(保留一位小数)。{已知:Ksp[Fe(OH)3]=1.0×10-39,Ksp[Al(OH)3]=2.7×10-34,lg3=0.52}
(5)滤液3中加入饱和Na2CO3溶液,过滤后,需要用“热水洗涤”的原因是_________。
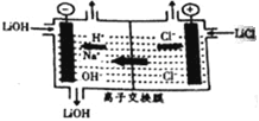
(6)为得到高纯度的Li2CO3,需将粗产品Li2CO3与盐酸反应制得的LiCl进行电解。其原理如图所示:
①电解时阳极的电解反应式为_____________________。
②电解后向产品LiOH溶液中加入过滤NH4HCO3溶液生成Li2CO3,反应的化学方程式为__________。