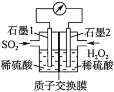
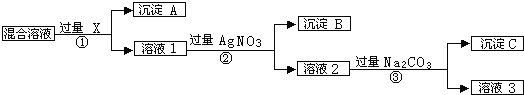
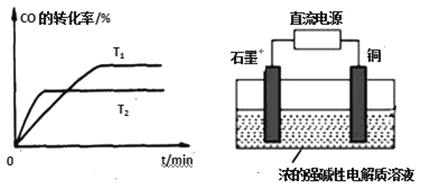
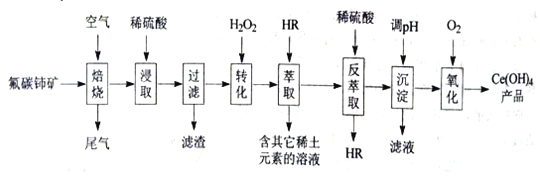
题目内容
【题目】100mL 0.3mol·L-1 Na2SO4溶液和50mL 0.2mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为(假设混合前后溶液体积变化忽略不计)( )
A.0.20mol·L-1B.0.25mol·L-1C.0.40mol·L-1D.0.50mol·L-1
【答案】C
【解析】
Na2SO4的物质的量为0.1L×0.3molL-1=0.03mol,则n(SO42-)=0.03mol,Al2(SO4)3的物质的量为:0.05L×0.2molL-1=0.01mol,则n(SO42-)=3×0.01mol=0.03mol,所以混合后溶液中n(SO42-)=0.03mol+0.03mol=0.06mol,混合后溶液的体积可以粗略认为是两溶液混合后体积之和,故硫酸根的物质的量浓度=![]() =0.40molL-1,所以C符合题意;故选C。
=0.40molL-1,所以C符合题意;故选C。

 阅读快车系列答案
阅读快车系列答案【题目】蛇纹石(含MgO、NiO、SiO2、Fe2O3、FeO等)因其外表青绿相问像蛇纹一样而得名。一种以蛇纹石为原料制取铁红和碱式碳酸镍[Ni3(OH)4CO34H2O]的流程如图:
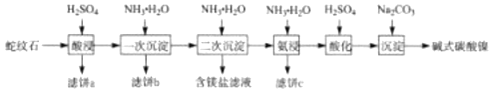
已知:Ⅰ.该实验温度下,不同pH时铁沉淀物成分及热分解产物:
pH | 铁沉淀物成分 | 热分解产物 |
2.5 | NH4Fe3(SO4)2(OH)6 | Fe2O3,SO2,SO3,NH3,O2,H2O |
3.5 | α-FeOOH | Fe2O3,H2O |
Ⅱ.部分金属离子沉淀的pH:
Mg2+ | Fe2+ | Ni2+ | |
开始沉淀的pH | 9.4 | 6.5 | 6.7 |
沉淀完全的pH | 12.4 | 9.7 | 9.5 |
Ⅲ.“氨浸“后所得溶液中主要成分为[Ni(NH3)6]2+,且存在[Ni(NH3)6]2+ Ni2++6NH3请回答:
(1)滤饼a的主要成分为___。
(2)滤饼b经洗涤、煅烧可得铁红。则“一次沉淀”时应控制pH=__(填“2.5或“3.5”),其原因为___。
(3)“氨浸”时生成[Ni(NH3)6]2+的离子方程式为___;此过程会同时加入 NH4HCO3,其目的为___。
(4)“沉淀”前须先”酸化”,用平衡移动原理解释其原因为__。
(5)实验室测得Ni3(OH)4CO34H2O(M=377)样品在空气中受热时样品失重率(失重率=固体样品损失的总质量/起始加入样品的质量×100%)与温度(T)的关系如图所示。

①200oC时所得固体的化学式为___。
②250~350oC之间反应的化学方程式为___。
(6)碱式碳酸镍可进一步转化制得镍氢电池。镍氢电池的工作原理为:Ni(OH)2+M![]() NiOOH+MH(M表示储氢金属或合金)。该电池充电过程中阴极的电极反应式为___。
NiOOH+MH(M表示储氢金属或合金)。该电池充电过程中阴极的电极反应式为___。