题目内容
【题目】稀土元素包括钪、亿和系共17种元素,是重要的战略资源,我国稀土资源丰富。从氟碳铈矿(主要化学成分为CeFCO3)提取铈族稀土元素的一种工艺流程如图:
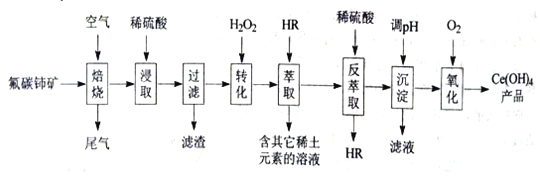
已知:①焙烧后铈元素主要以CeO2形式存在,Ce(
OH)3的Ksp=10×10-20
②Ce4+能与SO42-结合成[CeSO4]2+,Ce3+能被萃取剂HR萃取
(1)为提高原料的利用率,焙烧前应将矿石____处理。
(2)“浸取”过程中铈元素发生反应的离子方程式为___。
(3)“转化”过程中H2O2的作用是___。
(4)“萃取”过程中发生反应:Ce3+(水层)+3HR(有机层)CeR3(有机层)+3H+(水层)设计“萃取”和“反萃取”操作的目的是___;HR应该具有的特点是____。
a.萃取剂HR的密度一定比水大
b.萃取剂HR不溶于水,也不和水反应
c.萃取剂HR和Ce3+不反应
d.Ce3+在萃取剂中溶解度大于水中
(5)“调节pH”时,为了使Ce3+完全沉淀(浓度小于1×10-5mol/L),溶液的pH应大于___。
(6)“氧化”操作得到产品的化学方程式为____。
(7)CeO2是汽车尾气净化器中的关键催化剂,能在还原性气氛中供氧,在氧化性气氛中耗氧,过程为:2CeO22CeO2-x+xO2↑(0≤x≤0.5)。写出CeO2消除CO的化学方程式____。
【答案】粉碎 CeO2+4H++SO42-=[CeSO4]2++2H2O 作还原剂 进一步分离、富集Ce3+ bd 9 2H2O+4Ce(
OH)
3+O2=4Ce(OH)4 2xCO+CeO2=CeO2(1-x)+2xCO2
【解析】
由流程可知,焙烧前粉碎固体可增大接触面积,焙烧后铈元素主要以CeO2形式存在,加硫酸溶解后,过滤加过氧化氢发生2[CeSO4]2++2H2O2=2Ce3++2H2O+O2↑+2SO42-,Ce3+能被萃取剂HR萃取,通过“萃取”与“反萃取进一步分离、富集Ce3+,调节pH生成Ce(OH)3,最后氧化生成Ce(OH)4,以此来解答。
(1)为提高原料的利用率,焙烧前应将矿石粉碎处理,故答案为:粉碎;
(2)“浸取”过程中铈元素发生反应的离子方程式为CeO2+4H++SO42-=[CeSO4]2++2H2O,故答案为:CeO2+4H++SO42-=[CeSO4]2++2H2O;
(3)“转化”过程中H2O2的作用是作还原剂,故答案为:作还原剂;
(4)“萃取”过程中发生反应:Ce3+(水层)+3HR(有机层)CeR3(有机层)+3H+(水层)设计“萃取”和“反萃取”操作的目的是进一步分离、富集Ce3+;HR应该具有的特点是萃取剂HR不溶于水,也不和水反应、Ce3+在萃取剂中溶解度大于水中,故答案为:进一步分离、富集Ce3+;bd;
(5)“调节pH”时,为了使Ce3+完全沉淀(浓度小于1×10-5mol/L),Ce(OH)3的Ksp=1.0×10-20,c(OH-)=3![]() =1×10-5mol/L,溶液的pH应大于9,故答案为:9;
=1×10-5mol/L,溶液的pH应大于9,故答案为:9;
(6)“氧化”操作得到产品的化学方程式为2H2O+4Ce(OH)3+O2=4Ce(OH)4,
故答案为:2H2O+4Ce(OH)3+O2=4Ce(OH)4;
(7)一氧化碳和氧气反应生成二氧化碳,①2CO+O2=2CO2,在氧化气氛中耗氧在尾气消除过程中发生着②CeO2CeO2(1-x)+xO2↑(0≤x≤0.25)的循环,两式合并,①×x+②×2得到CeO2消除CO尾气的化学方程式为2xCO+CeO2=CeO2(1-x)+2xCO2,故答案为:2xCO+CeO2=CeO2(1-x)+2xCO2。

 阅读快车系列答案
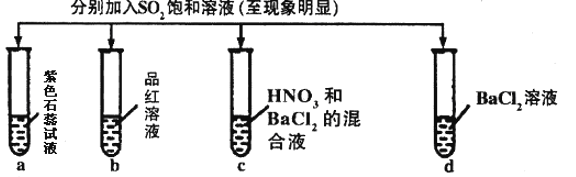
阅读快车系列答案【题目】下列有关SO2的性质的探究实验报告记录的实验现象正确的是
实验 |
| ||||
记录 | A | 无色 | 无色 | 无色溶液 | 无色溶液 |
B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
C | 红色 | 无色 | 白色沉淀 | 无色溶液 | |
D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
A.AB.BC.CD.D