题目内容
15.水煤气不仅是合成氨的原料气也是合成烃及其化工产品的原料.(1)直接水煤气燃料电池中,通CO、H2的极为电池的负极(选填:“正”,“负”).
(2)水煤气变换反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,下列措施能提高反应速率的有abc(不定项选择).
a.升高温度 b.加入催化剂 c.增大压强d.降低浓度
(3)由水煤气可以合成甲醇(CH3OH).已知0.5mol CH3OH(l)完全燃烧生成二氧化碳气体和液态水时放出热量为363.2kJ,写出CH3OH(l)燃烧的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.4KJ/mol.
分析 (1)燃料电池中燃料在负极发生氧化反应;
(2)影响化学反应速率的因素有温度、浓度、压强、催化剂、接触面积等等,据此分析;
(3)0.5mol甲醇放出363.2KJ热量,1mol甲醇弱酸放热726.4KJ,据此分析.
解答 解:(1)电池中负极发生氧化反应,燃料电池中氧气发生还原反应,热量反应氧化反应,故答案为:负;
(2)影响化学反应速率的因素有温度、浓度、压强、催化剂、接触面积等等,并且其与化学反应速率成正比,所以升高温度、加入催化剂、增大压强都能加快反应速率,降低浓度会减慢反应速率,故选abc;
(3)1mol甲醇弱酸放热726.4KJ,所以甲醇燃烧的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.4KJ/mol,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.4KJ/mol.
点评 本题考查了燃料电池电极反应类型、影响化学反应速率的因素、热化学方程式书写,题目难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
6.下列关于电离常数的说法正确的是( )
| A. | 电离常数随着弱电解质浓度的增大而增大 | |
| B. | CH3COOH的电离常数表达式为Ka=$\frac{c(C{H}_{3}COOH)}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$ | |
| C. | 电离常数只受温度影响,与浓度无关 | |
| D. | CH3COOH溶液中加入少量CH3COONa固体,电离常数减小 |
10.下列各项中表达正确的是( )
| A. | F-的结构示意图: | B. | CO2的分子模型示意图: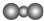 | ||
| C. | N2的结构式::N≡N: | D. | CSO的电子式: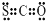 |
20.如表是元素周期表的一部分,针对表中的①⑩种元素,用 元素符号或化学式回答相关问题:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为 .
.
(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH
(3)⑤的单质与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程为Cl2+2Br-=2Cl-+Br2.
(5)①的单质常用做工业上合成某种碱性气体,写出该碱性气体被氧气催化氧化的反应化学方程式4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH
(3)⑤的单质与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程为Cl2+2Br-=2Cl-+Br2.
(5)①的单质常用做工业上合成某种碱性气体,写出该碱性气体被氧气催化氧化的反应化学方程式4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O.
7.化学与社会、生活密切相关,下列说法正确的是( )
| A. | 聚氯乙烯一次性超薄袋可用于包装食品 | |
| B. | 利用电渗析法和离子交换法能获得纯净水 | |
| C. | 体积分数为95%的酒精用作医用酒精 | |
| D. | 石油裂化的目的是得到乙烯、丙烯等化工原料 |
4.如表实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 向NaCl溶液中先滴加少量AgNO3溶液,后滴加少量NaI溶液,先有白色沉淀,后变成黄色沉淀 | 说明Ksp(AgI)<Ksp(AgCl) |
| B | 将SO2通入酸性KMnO4溶液中,紫色褪去 | 说明SO2具有漂白性 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 说明氧化性:Cu2+>Fe3+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有Ag+ |
| A. | A | B. | B | C. | C | D. | D |


 (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化) .
. .
.