题目内容
13.化学工业发展推动社会进步.请回答下列问题:(1)目前下列工艺过程没有直接使用离子交换技术的是D
A、硬水的软化 B、电解饱和食盐水制造NaOH
C、电渗析淡化海水 D、海水中提取金属镁
(2)提出联合制碱法的科学家是C
A.卢布兰 B.索尔维 C.侯德榜 D.哈伯
(3)关于合成氨工业的说法不正确的是D
A.常用铁触媒提高反应速率 B.原料气中的氮气来源于空气
C.通过冷凝把氨从混合气中分离出来 D.降低压强有利于氨的合成
(4)从沸腾炉排出的气体中不会使催化剂中毒的杂质是A
A、水蒸气 B 砷的化合物 C 硒的化合物 D 矿尘.
分析 (1)使用离子交换技术改变溶液中离子浓度,不会得到金属单质,以此来解答;
(2)“联合制碱法”又称侯氏制碱法,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96%;可与合成氨厂联合,生成的NH4Cl可做氮肥;
(3)A.合成氨工业中,铁触媒做催化剂;B.氮气在空气中丰富的来源;C.氨气易液化;D.氨的合成反应是个气体气体减小的反应;
(4)砷、硒等的化合物和矿尘等能使催化剂中毒.
解答 解:(1)A.硬水的软化,使用离子交换技术利用钠离子降低钙、镁离子的浓度,故A不选;
B.电解饱和食盐水制造NaOH,使用离子交换技术利用钠-氢交换、氯-氢氧根交换,故B不选;
C.电渗析淡化海水,使用离子交换膜对离子的选择性透过,故C不选;
D.海水中提取金属Mg,电解熔融氯化镁冶炼Mg,与离子交换技术无关,故D选;
故选D;
(2)A.卢布兰提出以普通食盐为原料,用硫酸处理得芒硝(见硫酸钠)及盐酸,芒硝再与石灰石、煤粉配合入炉煅烧生成纯碱的方法,故A错误;
B.比利时人索尔维以NaCl、CO2、H2O为原料生产Na2CO3,叫索尔维法,故B错误;
C.“联合制碱法”又称侯氏制碱法,是由我国科学家侯德邦改进索尔维法而摸索出的新的制取纯碱的方法,故C正确;
D.合成氨的发明者是哈伯,故D错误;
故选C;
(3)A.合成氨工业中,铁触媒做催化剂,故铁触媒能提高反应速率,故A正确;
B.氮气在空气中丰富的来源,即合成氨的原料氮气来自于空气,故B正确;
C.氨气易液化,故可用冷凝的方法将氨气分离,故C正确;
D.氨的合成反应是个气体气体减小的反应,故应增大压强使平衡右移,更有利于氨的合成,故D错误;
故选D;
(4)催化剂中毒就是杂质把催化剂覆盖着,阻止了它的反应,从沸腾炉排出的气体中砷的化合物、硒的化合物、矿尘能使催化剂中毒,
故选A.
点评 本题考查混合物分离提纯及海水资源的综合应用、化学的发展历史、合成氨工业、硫酸工业,注意把握几种制碱方法的不同,注意把握离子交换技术的原理及应用,题目难度中等.

| X | Y | Z | Q | |
| 反应前g | 20 | 20 | 20 | 20 |
| 反应后g | 10 | 20 | 26 | 24 |
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
方法一、还原法:在酸性介质中用FeSO4、NaHSO3等将+6价Cr还原成+3价Cr.具体流程如下:

有关离子完全沉淀的pH如下表.
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 |
| 完全沉淀的pH | 9.0 | 3.2 | 5.6 |
(1)在②中调节pH的范围至B为最好.(填序号)
A.3~4 B.6~8 C.10~11 D.12~14
(2)若在①使FeSO4适当过量、空气适量,使Fe2+与Fe3+的比例恰当时,可产生具有磁性、组成类似于Fe3O4•xH2O的铁氧体悬浮物,变废为宝.则控制空气适量的目的是使溶液中Fe2+与Fe3+的比例恰当,使铁氧体分离出来较简便的方法是用磁铁吸引.
方法二、电解法:将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3十在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(3)写出此阴极反应的电极方程式2H2O+2e-═H2↑+2OH-.现用上法处理1×104 L含铬(+6价)78mg/L的废水,电解时阳极物质消耗的质量至少为2.52kg.
| X | Y | |||
| Z | W | |||
| M |
| A. | M与Y可能形成M2Y3和M2Y5化合物 | |
| B. | 原子半径大小关系:Z>X>Y | |
| C. | 不能通过电解熔融Z、W组成的物质制备Z单质 | |
| D. | Y可以形成多种氢化物,其沸点均比X与H形成的化合物高 |
| A. | 3He和4He | B. | 乙烷和乙烯 | ||
| C. | 乙醇和二甲醚(CH3OCH3) | D. | O2和O3 |
| A. | 氢化物稳定性HmX>HnY | |
| B. | X的含氧酸的酸性比Y的含氧酸的酸性强 | |
| C. | X的单质(X2)能将Y的阴离子(Y2-)氧化,并发生置换反应 | |
| D. | X、Y的单质分别与Fe化合,产物中前者Fe为+3价,后者Fe为+2价 |
| Y | Z | W |
| Q |
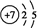 ,化合物X2Q的电子式为
,化合物X2Q的电子式为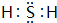 .
.(2)可溶性盐(ZX4)2Q2W8是强氧化剂,可将二价锰离子氧化为高锰酸根离子,所得溶液呈强酸性,写出该反应的离子方程式:2Mn2++5S2O82-+8H2O=2MnO4-+10SO42-+16H+.
(3)一定条件下,向容积不变的密闭容器中充入a mol QW2与b mol YW,发生反应生成YW2和液态Q单质,反应达到平衡时转移2.5mol电子,同时放出85kJ热量,则该反应的热化学方程式为SO2(g)+2CO(g)
 2CO2(g)+S(l)△H=-136 kJ•mol-1,欲使YW的平衡转化率大于QW2的平衡转化率,则a与b的关系为a:b>1:2.
2CO2(g)+S(l)△H=-136 kJ•mol-1,欲使YW的平衡转化率大于QW2的平衡转化率,则a与b的关系为a:b>1:2.