题目内容
9.CO2和CH4是两种主要的温室气体,以CH4和CO2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:(1)由CO2制取C的太阳能工艺如图1所示.
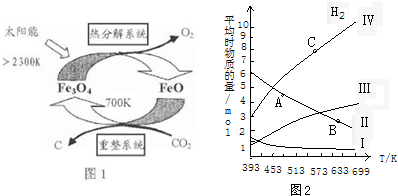
①“热分解系统”发生的反应为2Fe3O4 $\frac{\underline{\;>2300K\;}}{\;}$6FeO+O2↑,每分解lmolFe3O4转移电子的物质的量为2mol.
②“重整系统”发生反应的化学方程式为6FeO+CO2$\frac{\underline{\;700\;}}{\;}$2Fe3O4+C.
(2)一定条件下,CO2和CH4反应可生产合成气(CO、H2的混合气体),其可用于合成多种液体燃料.
已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H2=-802.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.0kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.7kJ•mol-1
(3)CH4也可经催化剂重整生产化工原料,最近科学家们在恒温恒容的密闭体系中利用CH4无氧重整获得芳香烃:8CH4(g)$→_{Pt}^{2MPa,550℃}$H2C-
 -CH3(g)+11H2△H=kJ•mol-1.
-CH3(g)+11H2△H=kJ•mol-1.下列有关该反应的说法中正确的是BC.
A、可研发新的催化剂,提高CH4的转化率
B、当体系压强不变时,反应达到平衡
C、当有32molC-H键断裂,同时有11molH-H键断裂,反应达到平衡
D、达到平衡时,放出(或吸收)的热量为mkJ
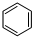
(4)CO2催化加氢可合成低碳烯烃,起始时在0.1MPa下,以n(H2):n(CO2)=3:1的投料比例将反应物放入反应器中,发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H,保持压强不变,不同温度下,平衡时的四种气态物质的量如图2所示:
①曲线Ⅱ表示的物质为H2O(填化学式),该反应的△H<(填“>”或“<”)0.
②A、B两点对应的反应的反应速率v(A)、v(B)的大小关系为v(A)<v(B).B、C两点对应温度下反应的平衡常数大小关系为K(B)<(填“>”“<”或“=”)K(C)
③为提高CO2平衡转化率,除改变温度外,还可以采取的措施是增大压强或增大n(H2)/n(CO2)的比值.(举一种)
分析 (1)①反应2Fe3O4$\frac{\underline{\;2300K\;}}{\;}$6FeO+O2↑中O元素化合价由-2价升高到0价,结合元素化合价以及方程式计算;
②由示意图可知,重整系统中CO2和FeO反应生成Fe3O4和C;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式,根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)?2CO(g)+2H2(g);
(3)A、催化剂改变反应速率不改变化学平衡;
B、反应前后气体体积增大,气体压强之比等于气体物质的量之比,气体压强不变,反应达到平衡状态;
C、当有32molC-H键断裂,同时有11molH-H键断裂,说明正逆反应速率相同;
D、依据化学方程式分析,区别焓变和反应放出的热量,焓变是指8mol甲烷完全反应放出或吸收的热量为mkJ;
(4)①根据题给图象知,平衡时氢气的物质的量随温度的升高而增大,则曲线a代表反应物CO2,曲线b、c表示生成物,又曲线b表示的物质平衡时物质的量大,结合方程式分析,曲线b表示的物质为H2O,据题给图象知,平衡时氢气的物质的量随温度的升高而增大,平衡逆向移动,该反应的△H<0;
②温度越高,反应速率越大,反应是放热反应,升温平衡逆向进行,平衡常数减小;
③该反应为气体物质的量减小的放热反应,为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强或增大n(H2)/n(CO2)的比值.
解答 解:(1)①反应2Fe3O4$\frac{\underline{\;2300K\;}}{\;}$6FeO+O2↑中O元素化合价由-2价升高到0价,由方程式可知,2molFe3O4参加反应,生成1mol氧气,转移4mol电子,则每分解lmolFe3O4转移电子的物质的量为2mol,
故答案为:2mol;
②由示意图可知,重整系统中CO2和FeO反应生成Fe3O4和C,反应的方程式为6FeO+CO2$\frac{\underline{\;700K\;}}{\;}$2Fe3O4+C,故答案为:6FeO+CO2$\frac{\underline{\;700\;}}{\;}$2Fe3O4+C;
(2)①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H2=-802.3kJ•mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.0kJ•mol-1
③2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=[-802.3-2×41.0-(-566)×2]kJ•mol-1=+247.7KJ/mol,
故答案为:247.7;
(3)A、催化剂改变反应速率不改变化学平衡,不能提高CH4的转化率,故A错误;
B、反应前后气体体积增大,气体压强之比等于气体物质的量之比,气体压强不变,说明反应达到平衡状态,故B正确;
C、当有32molC-H键断裂,同时有11molH-H键断裂,说明正逆反应速率相同,反应达到平衡状态,故C正确;
D、依据化学方程式分析,区别焓变和反应放出的热量,焓变是指8mol甲烷完全反应放出或吸收的热量为mkJ,故D错误;
故选BC;
(4)①根据题给图象知,平衡时氢气的物质的量随温度的升高而增大,则曲线a代表反应物CO2,曲线b、c表示生成物,又曲线b表示的物质平衡时物质的量大,结合方程式分析,曲线Ⅱ表示的物质为H2O,据题给图象知,平衡时氢气的物质的量随温度的升高而增大,平衡逆向移动,该反应的△H<0;
故答案为:H2O;<;
②温度越高,反应速率越大,B点温度高,所以A、B两点对应的反应的反应速率v(A)<v(B),依据①分析可知反应是放热反应,升温平衡逆向进行,平衡常数减小,B点温度高平衡常数是小,B、C两点对应温度下反应的平衡常数大小关系为K(B)<K(C);
故答案为:v(A)<v(B);<;
③2CO2(g)+6H2(g)?C2H4(g)+4H2O(g),该反应为气体物质的量减小的放热反应,为提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强或增大n(H2)/n(CO2)的比值;
故答案为:增大压强或增大n(H2)/n(CO2)的比值.
点评 本题考查热化学方程式书写方法和盖斯定律的计算应用,化学平衡、平衡常数、反应速率的影响因素分析,图象分析判断是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子的电子层数比B原子的电子层数少 | |
| C. | 1mol A从稀硫酸中置换的氢气比1mol B置换的氢气多 | |
| D. | 常温下,A能从冷水中置换出氢气,而B不能 |
| A. | NaCl | B. | KCl | C. | CaO | D. | MgO |
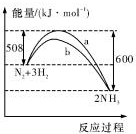
| A. | 该反应的热化学方程式为:2NH3?N2+3H2△H=-92kJ.mol-1 | |
| B. | 生成物的能量之和比反应物的能量之和高 92 kJ | |
| C. | a曲线是未加入催化剂时的能量变化曲线 | |
| D. | 加入催化剂可增加正反应速率,减小逆反应速率 |
| A. | 3种 | B. | 9种 | C. | 12种 | D. | 6种 |
 等,下列化合物中存在对映异构体的是( )
等,下列化合物中存在对映异构体的是( )| A. | 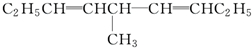 | B. | 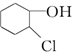 | ||
| C. | 甲酸 | D. | C6H5CH2OCH3 |
| A. | 它是${\;}_{8}^{16}$O2的同分异构体 | |
| B. | 它是O3的一种同素异形体 | |
| C. | ${\;}_{8}^{18}$O2与${\;}_{8}^{16}$O2互为同位素 | |
| D. | 1mol ${\;}_{8}^{18}$O2分子中含有20mol电子 |
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.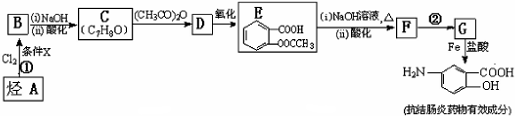
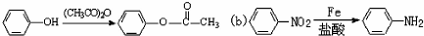
 ;
; ;
;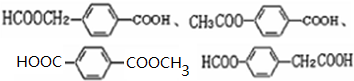 ;
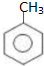
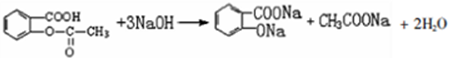
;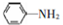 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物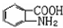 的合成路线
的合成路线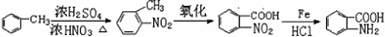 ..(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
..(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)