题目内容
4.某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):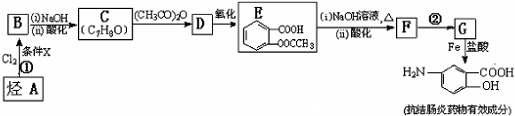
已知:(a)
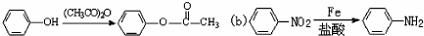
(1)烃A的结构简式是
 ;
;(2)①的反应条件是Fe或氯化铁;②的反应类型是取代反应或硝化反应;
(3)下列对抗结肠炎药物有效成分可能具有的物质推测正确的是:ACD;
A.水溶性比苯酚好,密度比苯酚的大
B.能发生消去反应
C.能发生聚合反应
D.既有酸性又有碱性
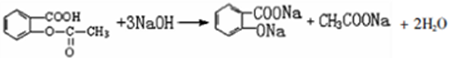
(4)E与足量NaOH溶液反应的化学方程式是
 ;
;(5)写出所有符合下列条件的E的同分异构体的结构简式:
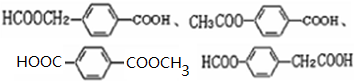 ;
;a.与E具有相同的官能团
b.苯环上的一硝基取代产物有两种
(6)已知
 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物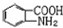 的合成路线
的合成路线 ..(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
..(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
分析 烃A和氯气发生取代反应生成B,B发生水解反应然后酸化得到C,从A到B、B到C反应过程中碳原子个数不变,所以A为 ,根据E结构简式知,甲苯苯环上甲基邻位H原子被氯原子取代生成B,B结构简式为
,根据E结构简式知,甲苯苯环上甲基邻位H原子被氯原子取代生成B,B结构简式为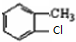 ,C为
,C为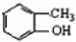 ,C和乙酸酐发生取代反应生成D,D为
,C和乙酸酐发生取代反应生成D,D为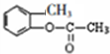 ,D
,D
被氧化生成E,E水解然后酸化得到F,F结构简式为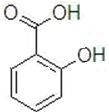 ,G和Fe、盐酸反应生成
,G和Fe、盐酸反应生成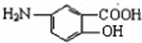 ,结合题给信息知,G为
,结合题给信息知,G为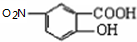 ,F发生取代反应生成G,据此分析解答.
,F发生取代反应生成G,据此分析解答.
解答 解:烃A和氯气发生取代反应生成B,B发生水解反应然后酸化得到C,从A到B、B到C反应过程中碳原子个数不变,所以A为 ,根据E结构简式知,甲苯苯环上甲基邻位H原子被氯原子取代生成B,B结构简式为
,根据E结构简式知,甲苯苯环上甲基邻位H原子被氯原子取代生成B,B结构简式为 ,C为
,C为 ,C和乙酸酐发生取代反应生成D,D为
,C和乙酸酐发生取代反应生成D,D为 ,D
,D
被氧化生成E,E水解然后酸化得到F,F结构简式为 ,G和Fe、盐酸反应生成
,G和Fe、盐酸反应生成 ,结合题给信息知,G为
,结合题给信息知,G为 ,F发生取代反应生成G,
,F发生取代反应生成G,
(1)烃A的结构简式是 ,故答案为:
,故答案为: ;
;
(2)①的反应条件是Fe或氯化铁作催化剂;②的反应类型是取代反应或硝化反应,
故答案为:Fe或氯化铁;取代反应或硝化反应;
(3)A.该分子中含有酚羟基、羧基及氨基,都属于亲水基,所以水溶性比苯酚好,密度比苯酚的大,故正确;
B.该分子中含有酚羟基、羧基和氨基,不能发生消去反应,故错误;
C.含有酚羟基和羧基,所以能发生聚合反应生成高分子化合物,故正确;
D.含有羧基和氨基,具有氨基酸的性质,所以既有酸性又有碱性,故正确;
故选ACD;
(4)E与足量NaOH溶液反应的化学方程式是 ,
,
故答案为: ;
;
(5)E的同分异构体符合下列条件:a.与E具有相同的官能团说明含有酯基和羧基,
b.苯环上的一硝基取代产物有两种,说明苯环上氢原子有两种,符合条件的同分异构体有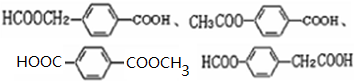 ,
,
故答案为: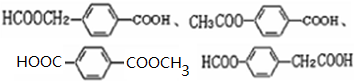 ;
;
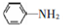
(6)甲苯和浓硝酸发生取代反应生成邻甲基硝基苯,邻甲基硝基苯和酸性高锰酸钾溶液氧化生成邻硝基苯甲酸,邻硝基苯甲酸和Fe、HCl反应生成邻氨基苯甲酸,其合成路线为 ,
,
故答案为: .
.
点评 本题考查有机合成和有机推断,侧重考查学生分析推断及合成路线设计能力,明确官能团及其性质关系是解本题关键,根据反应物、目标产物结构简式结合反应条件进行推断,注意题给信息的合理运用,注意反应先后顺序,题目难度中等.

| A. | 电解、电镀、电化学腐蚀都需要通电才可进行 | |
| B. | Al、Fe、Cu三者对应的氧化物均为碱性氧化物 | |
| C. | 浓H2SO4和新制氯水分别滴在pH试纸上均会出现先变红后褪色的现象 | |
| D. | 氢氧化铝可以中和过多的胃酸 |
| A. | NaBr和NaI | B. | NaCl | C. | NaBr和NaCl | D. | NaCl和 I2 |
| A. | 硝酸的标签上应标注 和 和 | B. | 硫离子结构示意图: | ||
| C. | HClO的电子式: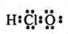 | D. | 239Pu比235U原子核内多4个中子 |
| A. | 二甲苯有三种同分异构体 | |
| B. | 二甲苯和甲苯是同系物 | |
| C. | 二甲苯分子中,所有碳原子都在同一个平面上 | |
| D. | 1mol二甲苯完全燃烧后,生成的二氧化碳和水的物质的量相等 |
| A. | Z2Y2 | B. | X2Y2 | C. | Z2Y | D. | ZYX |
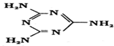 ,则其中氮原子轨道杂化类型是sp2、sp3,l mol三聚氰胺分子中含15molσ键.
,则其中氮原子轨道杂化类型是sp2、sp3,l mol三聚氰胺分子中含15molσ键.

 -CH3(g)+11H2△H=kJ•mol-1.
-CH3(g)+11H2△H=kJ•mol-1.