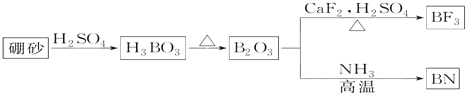
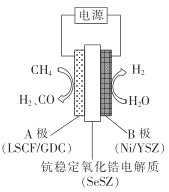
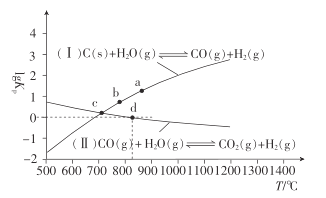
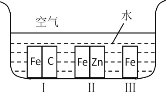
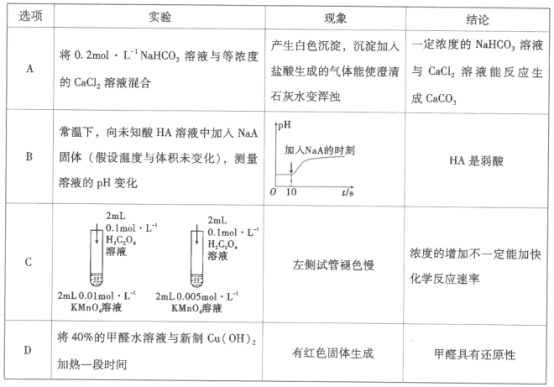
ЬтФПФкШн
ЁОЬтФПЁПвдвјОЋПѓ(жївЊГЩЗжЮЊAg2S)ЮЊдСЯВЩгУЁАдЄбѕЛЏЪЊЗЈЬсвјЁБЙЄвеСїГЬШчЯТ:
(1)N2H4ЕФЕчзгЪНЮЊ________________________ЁЃ
(2)ЁАЗжРызЊЛЏЁБЪБ,Ag2SзЊЛЏЮЊAgClКЭSЕФЛЏбЇЗНГЬЪНЮЊ______________(ClO3-ЛЙдЮЊCl- );ЮЊЬсИпAg2SЕФзЊЛЏТЪПЩВЩШЁЕФДыЪЉЪЧ_____________(СаОй2Ьѕ)ЁЃвбжЊ:Ksp(Ag2S)=1. 6ЁС10-49 ,Ksp(AgCl)=2. 0ЁС10-10 ,ШєВЛМгKClO3,жБНгМгТШЛЏЮя,вРОнЗДгІAg2S+2Cl-![]() 2AgCl+S2- ,ФмЗёЪЕЯжЦфНЯЭъШЋзЊЛЏ?ВЂЫЕУїРэгЩ:________________
2AgCl+S2- ,ФмЗёЪЕЯжЦфНЯЭъШЋзЊЛЏ?ВЂЫЕУїРэгЩ:________________
(3)ЁАНўвјЁБЪБЃЌЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ________________________ЁЃ
(4)ЁАЛЙдЁБЪБ,2[ Ag(SO3)2]3- +N2H4+2OH -=2AgЁ§+4SO32- +N2Ёќ+H2Ёќ+ 2H2O,ИУЗДгІУПЩњГЩ1 mol AgзЊвЦЕчзгЕФЮяжЪЕФСПЮЊ___________ЁЃ
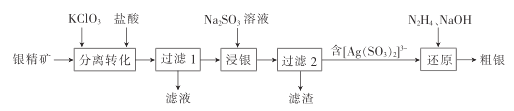
ЁОД№АИЁП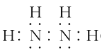 3Ag2S+6HCl+KClO3 =6AgCl+KCl+3S+3H2O ЪЪЕБбгГЄНўШЁЪБМфЃЌМѕаЁвјОЋПѓСЃжБОЖЃЌЪЪЕБЩ§ИпНўГіЪБЕФЮТЖШЕШ ВЛФмЃЌИУЗДгІЕФЦНКтГЃЪ§МЋаЁ(K=41030)ЃЌМИКѕВЛФмзЊЛЏ AgCl+2SO32-=[Ag(SO3)2]3 +Cl 2mo1
3Ag2S+6HCl+KClO3 =6AgCl+KCl+3S+3H2O ЪЪЕБбгГЄНўШЁЪБМфЃЌМѕаЁвјОЋПѓСЃжБОЖЃЌЪЪЕБЩ§ИпНўГіЪБЕФЮТЖШЕШ ВЛФмЃЌИУЗДгІЕФЦНКтГЃЪ§МЋаЁ(K=41030)ЃЌМИКѕВЛФмзЊЛЏ AgCl+2SO32-=[Ag(SO3)2]3 +Cl 2mo1
ЁОНтЮіЁП
ЁАЗжРызЊЛЏЁБЪБЃЌAg2SЁЂHClгыKClO3ЗДгІзЊЛЏЮЊAgClЁЂSЁЂKClКЭH2OЃЌЙ§ТЫЃЌЁАНўвјЁБЪБЃЌAgClгыSO32 ЗДгІЩњГЩ[Ag(SO3)2]3ЃЌЁАЛЙдЁБЪБЃЌ[Ag(SO3)2]3 ЁЂN2H4КЭNaOHЗДгІЩњГЩAgЁЂSO32ЁЂN2ЁЂH2КЭH2OЁЃ
(1)N2H4жаЕЊгаШ§ИіЙВМлМќЃЌУПИіЕЊЗжБ№гыСНИіЧтаЮГЩЙВМлМќЃЌЕЊКЭЕЊжЎМфвЛЖдЙВгУЕчзгЃЌвђДЫЕчзгЪНЮЊ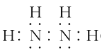 ЃЛЙЪД№АИЮЊЃК
ЃЛЙЪД№АИЮЊЃК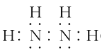 ЁЃ
ЁЃ
(2)ЁАЗжРызЊЛЏЁБЪБЃЌAg2SЁЂHClгыKClO3ЗДгІзЊЛЏЮЊAgClЁЂSЁЂKClКЭH2OЃЌЦфЛЏбЇЗНГЬЪНЮЊ3Ag2S+6HCl+KClO3 =6AgCl+KCl+3S+3H2OЃЛЮЊЬсИпAg2SЕФзЊЛЏТЪПЩВЩШЁЕФДыЪЉЪЧЪЪЕБбгГЄНўШЁЪБМфЃЌМѕаЁвјОЋПѓСЃжБОЖЃЌЪЪЕБЩ§ИпНўГіЪБЕФЮТЖШЕШ(СаОй2Ьѕ)ЃЛвРОнЗДгІAg2S+2ClЃ![]() 2AgCl+S2ЃЌ
2AgCl+S2ЃЌ ЃЌИУЗДгІЕФЦНКтГЃЪ§МЋаЁ(K=41030)ЃЌМИКѕВЛФмзЊЛЏЃЛЙЪД№АИЮЊЃК3Ag2S+6HCl+KClO3 =6AgCl+KCl+3S+3H2OЃЛЪЪЕБбгГЄНўШЁЪБМфЃЌМѕаЁвјОЋПѓСЃжБОЖЃЌЪЪЕБЩ§ИпНўГіЪБЕФЮТЖШЕШ(СаОй2Ьѕ)ЃЛВЛФмЃЌИУЗДгІЕФЦНКтГЃЪ§МЋаЁ(K=41030)ЃЌМИКѕВЛФмзЊЛЏЁЃ
ЃЌИУЗДгІЕФЦНКтГЃЪ§МЋаЁ(K=41030)ЃЌМИКѕВЛФмзЊЛЏЃЛЙЪД№АИЮЊЃК3Ag2S+6HCl+KClO3 =6AgCl+KCl+3S+3H2OЃЛЪЪЕБбгГЄНўШЁЪБМфЃЌМѕаЁвјОЋПѓСЃжБОЖЃЌЪЪЕБЩ§ИпНўГіЪБЕФЮТЖШЕШ(СаОй2Ьѕ)ЃЛВЛФмЃЌИУЗДгІЕФЦНКтГЃЪ§МЋаЁ(K=41030)ЃЌМИКѕВЛФмзЊЛЏЁЃ
(3)ЁАНўвјЁБЪБЃЌAgClгыSO32 ЗДгІЩњГЩ[Ag(SO3)2]3ЃЌЦфЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊAgCl+ 2SO32 = [Ag(SO3)2]3 +ClЃЃЛЙЪД№АИЮЊЃКAgCl+2SO32 = [Ag(SO3)2]3 +ClЃЁЃ
(4)ЁАЛЙдЁБЪБЃЌ2[Ag(SO3)2]3 +N2H4+2OHЃ =2AgЁ§+4SO32 + N2Ёќ+H2Ёќ+ 2H2OЃЌЗжЮіЗНГЬЪНжаAgЛЏКЯМлНЕЕЭЃЌNЛЏКЯМлЩ§ИпЃЌHЛЏКЯМлНЕЕЭЃЌЕУЕН2molAgЕчзгзЊвЦ4molЃЌвђДЫЗДгІУПЩњГЩ1 mol AgзЊвЦЕчзгЕФЮяжЪЕФСПЮЊ2molЃЛЙЪД№АИЮЊЃК2molЁЃ

ЁОЬтФПЁПХ№(B)МАЦфЛЏКЯЮядкЛЏбЇЙЄвЕжагажюЖргУЭОЁЃЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉХ№ЧтЛЏФЦ(NaBH4)ЪЧХ№ЕФживЊЛЏКЯЮяЁЃ
ЂйNaBH4жаBдЊЫиЕФЛЏКЯМлЮЊ___ЁЃ
![]() ЙЄвЕЩЯПЩРћгУХ№ЫсМзѕЅ[B(OCH3)3]гыЧтЛЏФЦ(NaH)ЗДгІжЦБИNaBH4ЃЌЗДгІЕФСэвЛжжВњЮяЮЊМзДМФЦ(CH3ONa)ЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ___ЁЃNaBH4гыЫЎЗДгІЩњГЩNaBO2КЭH2ЃЌИУЗДгІЩњГЩЕФбѕЛЏВњЮягыЛЙдВњЮяЕФЮяжЪЕФСПжЎБШЮЊ___ЁЃ
ЙЄвЕЩЯПЩРћгУХ№ЫсМзѕЅ[B(OCH3)3]гыЧтЛЏФЦ(NaH)ЗДгІжЦБИNaBH4ЃЌЗДгІЕФСэвЛжжВњЮяЮЊМзДМФЦ(CH3ONa)ЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ___ЁЃNaBH4гыЫЎЗДгІЩњГЩNaBO2КЭH2ЃЌИУЗДгІЩњГЩЕФбѕЛЏВњЮягыЛЙдВњЮяЕФЮяжЪЕФСПжЎБШЮЊ___ЁЃ
ЃЈ2ЃЉЙЄвЕЩЯвдЬњХ№Пѓ(жївЊГЩЗжЮЊMg2B2O5ЁЄH2OЃЌЛЙгаЩйСПFe2O3ЁЂFeOЁЂCaOЁЂAl2O3КЭSiO2ЕШ)ЮЊдСЯжЦБИЕЅжЪBЕФЙЄвеСїГЬШчЭМЫљЪОЃК
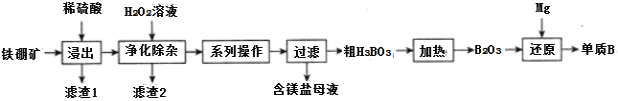
вбжЊЃК
Н№ЪєРызг | Fe3+ | Al3+ |
ПЊЪМГСЕэЕФPH | 2.7 | 3.1 |
ГСЕэЭъШЋЕФPH | 3.7 | 4.9 |
![]() ЁАНўГіЁБЪБЃЌНЋЬњХ№ПѓЪЏЗлЫщЕФФПЕФЮЊ___ЁЃ
ЁАНўГіЁБЪБЃЌНЋЬњХ№ПѓЪЏЗлЫщЕФФПЕФЮЊ___ЁЃ
![]() ТЫдќ1ЕФжївЊГЩЗжЮЊ___ЁЃ
ТЫдќ1ЕФжївЊГЩЗжЮЊ___ЁЃ
![]() ЁАОЛЛЏГ§дгЁБЪБашЯШМгH2O2ШмвКЃЌЦфФПЕФЮЊ___ЃЌШЛКѓдйЕїНкШмвКЕФpHЁж5.0ЕФФПЕФЪЧ___ЁЃ
ЁАОЛЛЏГ§дгЁБЪБашЯШМгH2O2ШмвКЃЌЦфФПЕФЮЊ___ЃЌШЛКѓдйЕїНкШмвКЕФpHЁж5.0ЕФФПЕФЪЧ___ЁЃ
![]() жЦЕУЕФДжХ№дквЛЖЈЬѕМўЯТФмЩњГЩBI3ЃЌBI3МгШШЗжНтПЩвдЕУЕНДПОЛЕФЕЅжЪХ№ЁЃЯжНЋ0.025gДжХ№жЦГЩЕФBI3ЭъШЋЗжНтЃЌЩњГЩЕФI2гУ0.30molЁЄL-1Na2S2O3ШмвКЕЮЖЈ(I2+2S2O32-=2I-+S4O62-)жСжеЕуЃЌЯћКФ18.00mLNa2S2O3ШмвКЁЃЪЂзАNa2S2O3ШмвКгІгУ___(ЬюЁАЫсЪНЁБЛђЁАМюЪНЁБ)ЕЮЖЈЙмЃЌИУДжХ№бљЦЗЕФДПЖШЮЊ___ЁЃ
жЦЕУЕФДжХ№дквЛЖЈЬѕМўЯТФмЩњГЩBI3ЃЌBI3МгШШЗжНтПЩвдЕУЕНДПОЛЕФЕЅжЪХ№ЁЃЯжНЋ0.025gДжХ№жЦГЩЕФBI3ЭъШЋЗжНтЃЌЩњГЩЕФI2гУ0.30molЁЄL-1Na2S2O3ШмвКЕЮЖЈ(I2+2S2O32-=2I-+S4O62-)жСжеЕуЃЌЯћКФ18.00mLNa2S2O3ШмвКЁЃЪЂзАNa2S2O3ШмвКгІгУ___(ЬюЁАЫсЪНЁБЛђЁАМюЪНЁБ)ЕЮЖЈЙмЃЌИУДжХ№бљЦЗЕФДПЖШЮЊ___ЁЃ