题目内容
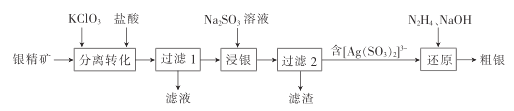
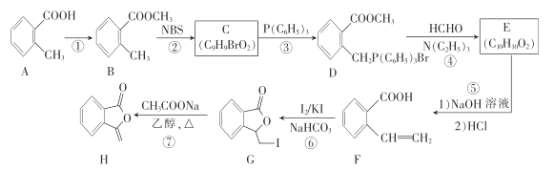
【题目】合成气用途非常广泛,可以煤、天然气等为原料生产。回答下列问题:
(1)用H2O(g)和O2重整CH4制合成气的热化学方程式如下:
(水蒸气重整)CH4(g)+ H2O(g)=CO(g)+3H2(g) H=+ 206 kJ●mol -1
(氧气重整)CH4(g)+0.5O2(g)=CO(g)+2H2(g) H=-36 kJ●mol-1
①2H2(g)+O2(g)=2H2O(g)的 H=_______kJ●mol-1。
②为了保持热平衡,同时用两种方式重整,不考虑热量损失,理论上得到的合成气中n(CO): n(H2)=1 :____(保留两位小数)。
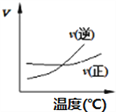
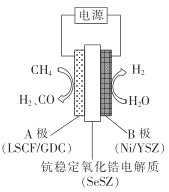
③用水蒸气电催化重整甲烷的装置如图。装置工作时,O2-向_____(填“A"或“B’)极迁移;阳极发生的电极反应为___________。
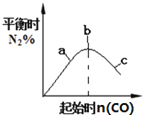
(2)焦炭与水蒸气在恒容密闭容器中反应制合成气的主要反应( I )、(II )的lgKp(Kp为以分压表示的平衡常数)与T的关系如下图所示。
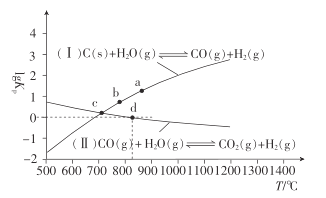
①反应(II)的H_____(填“大于”“等于”或“小于”)0。
②气体的总压强:a点_____ (填“大于”“等 于”或“小于”)b点,理由是_________。
③c点时,反应C(s) +CO2(g)![]() 2CO(g)的Kp=_____ (填数值)。
2CO(g)的Kp=_____ (填数值)。
④在恒容密闭容器中充入0. 5 mol CO、2 mol H2O(g)只发生反应(II),图中d点处达到平衡时,CO的转化率为_______;达到平衡时,向容器中再充入0.5 mol CO、2 mol H2O(g),重新达到平衡时,CO的平衡转化率_______(填“增大”“减小”或“不变”)。
【答案】484 2.15 A CH4 + O2 2e- = CO+2H2 小于 大于 容积一定,压强与气体的总物质的量、温度均成正比,a点的温度比b点的高,a点的气体的总物质的量比b点的大,故P(a)>P(b) 1 80% 不变
【解析】
(1)①将第二个方程式的2倍减去第一个方程式的2倍;②为了保持热平衡,同时用两种方式重整,不考虑热量损失,两者吸收和放出热量相等进行计算;③装置工作时,根据图中信息水变氢气,化合价降低得到电子,在电解池的阴极即B为阴极,根据电解池中异性相吸原则,阳极甲烷变为氢气和CO。
(2)①反应(II)升高温度,lgKp变小,即Kp变小,平衡逆向移动,逆向是吸热反应;②a点、b点容器一样大,压强与容器内气体的物质的量,温度成正比;③将反应I减去反应II得到C(s) +CO2(g)![]() 2CO(g),因此C(s) +CO2(g)
2CO(g),因此C(s) +CO2(g)![]() 2CO(g)的平衡常数等于反应I的平衡常数除以反应II的平衡常数;④建立三段式并建立方程式计算d点CO的消耗量并计算转化率;用建模思想来分析又加入0.5 mol CO、2 mol H2O(g)达到平衡时转化率。
2CO(g)的平衡常数等于反应I的平衡常数除以反应II的平衡常数;④建立三段式并建立方程式计算d点CO的消耗量并计算转化率;用建模思想来分析又加入0.5 mol CO、2 mol H2O(g)达到平衡时转化率。
(1)①将第二个方程式的2倍减去第一个方程式的2倍,2H2(g)+O2(g)=2H2O(g) H= 2×(36)kJ·mol1(+206) kJ·mol1 = 484 kJ·mol1;故答案为:484。
②为了保持热平衡,同时用两种方式重整,不考虑热量损失,两者吸收和放出热量相等进行计算,理论上得到的合成气中n(CO):n(H2)=(36+206):(3×36+2×206) = 1:2.15;故答案为:2.15。
③装置工作时,根据图中信息水变氢气,化合价降低得到电子,在电解池的阴极即B为阴极,根据电解池中异性相吸原则,O2向阳极即A极迁移,阳极甲烷变为氢气和CO,其发生的电极反应为CH4 + O2 2e- = CO+2H2;故答案为:A;CH4 + O2 2e- = CO + 2H2。
(2)①反应(II)升高温度,lgKp变小,即Kp变小,平衡逆向移动,逆向是吸热反应,正向放热反应即H小于0;故答案为:小于。
②a点、b点容器一样大,压强与容器内气体的物质的量,温度成正比,a点温度比b点温度高,a点气体的总物质的量比b点气体的总物质的量多,因此气体的总压强:a点大于b点;故答案为:大于;容积一定,压强与气体的总物质的量、温度均成正比,a点的温度比b点的高,a点的气体的总物质的量比b点的大,故P(a)>P(b)。
③将反应I减去反应II得到C(s) +CO2(g)![]() 2CO(g),因此C(s) +CO2(g)
2CO(g),因此C(s) +CO2(g)![]() 2CO(g)的平衡常数等于反应I的平衡常数除以反应II的平衡常数,由于c点时,两者的Kp相等,Kp=1;故答案为:1。
2CO(g)的平衡常数等于反应I的平衡常数除以反应II的平衡常数,由于c点时,两者的Kp相等,Kp=1;故答案为:1。
④在恒容密闭容器中充入0. 5 mol CO、2 mol H2O(g)只发生反应(II),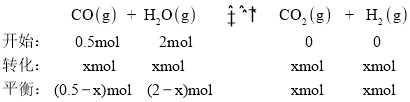
图中d点处达到平衡时,设总压强为P0,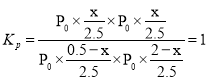 ,解得x=0.4,因此CO的转化率
,解得x=0.4,因此CO的转化率![]() ;达到平衡时;向容器中再充入0.5 mol CO、2 mol H2O(g),可以理解为取另一个容器充入0.5 mol CO、2 mol H2O(g),达到平衡时转化率和原来一样,将两个容器压缩到一个容器中,平衡不移动,因此重新达到平衡时;CO的平衡转化率不变;故答案为:80%;不变。
;达到平衡时;向容器中再充入0.5 mol CO、2 mol H2O(g),可以理解为取另一个容器充入0.5 mol CO、2 mol H2O(g),达到平衡时转化率和原来一样,将两个容器压缩到一个容器中,平衡不移动,因此重新达到平衡时;CO的平衡转化率不变;故答案为:80%;不变。

 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案【题目】下列有关物质检验的实验结论正确的是( )
实验操作 | 现象 | 结论 | |
A | 某溶液中加入氯化钡溶液 | 生成白色沉淀 | 该溶液一定含有SO42- |
B | 某溶液中加入无色酚酞试液 | 溶液变红色 | 该溶液一定是碱溶液 |
C | 将某溶液做焰色反应 | 焰色呈黄色 | 该溶液一定含有Na+ |
D | 往某溶液中加入盐酸 | 产生无色气体 | 该溶液一定含有CO32- |
A.AB.BC.CD.D