题目内容
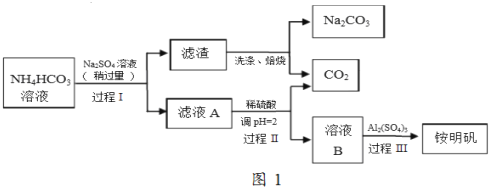
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:
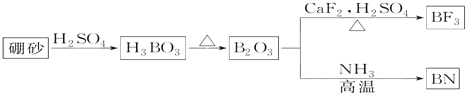
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式是___、___。
(2)基态B原子的电子排布式为___;B和N相比,非金属性较强的是___,BN中B元素的化合价为___;
(3)在BF3分子中,F﹣B﹣F的键角是___,该分子为___分子(填写“极性” 或“非极性”),BF3和过量NaF作用可生成NaBF4,BF4-中可能含有___,立体结构为___;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为___,层间作用力为___。
【答案】B2O3+3CaF2+3H2SO4→3H2O+2BF3+3CaSO4 B2O3+2NH3→2BN+3H2O 1s22s22p1 N +3 120° 非极性 共价键、配位键 正四面体 共价键 范德华力
【解析】
硼砂与硫酸生成H3BO3,H3BO3受热分解得到B2O3,B2O3与CaF2、硫酸加热得到BF3,B2O3与氨气高温下得到BN;
(1)由工艺流程可知,B2O3与NH3反应生成BN,根据原子守恒可知,还有水生成;由图可知B2O3与CaF2和H2SO4反应即生成BF3,同时还应该产生硫酸钙和水;
(2)B原子核外有5个电子,根据构造原理书写基态B原子的电子排布式;同周期主族元素,从左向右,核电荷数增大,元素的非金属性增强,电负性越大,B元素化合价为+3价;
(3)价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果,先判断价层电子对数,再确定分子构型,进而判断键角和分子的极性,以及离子的空间构型;
(4)结合化学键的形成条件和分子间作用力分析。
(1)由工艺流程可知,B2O3与NH3反应生成BN,根据原子守恒可知,还有水生成,反应方程式为:B2O3+2NH3 ![]() 2BN+3H2O,由图及元素守恒可知生成、BF3反应的方程式:B2O3+3CaF2+3H2SO4
2BN+3H2O,由图及元素守恒可知生成、BF3反应的方程式:B2O3+3CaF2+3H2SO4 ![]() 2BF3↑+3CaSO4+3H2O;
2BF3↑+3CaSO4+3H2O;
(2)B原子核外有5个电子,根据构造原理书写基态B原子的电子排布式为1s22s22p1;B、N为同周期主族元素,核电荷数大,元素的非金属性越强,则非金属性N>B,电负性N>B,NB中B元素化合价为+3价;
(3)BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=![]() (a-xb)=
(a-xb)=![]() (0-3×1)=0,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,键角是120°,分子是非极性分子,BF3和过量NaF作用可生成NaBF4,BF4-中B原子最外层只有3个电子,最多3个共用电子,则BF4-中应含有共价键和配位键;B原子的价层电子对=3+
(0-3×1)=0,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,键角是120°,分子是非极性分子,BF3和过量NaF作用可生成NaBF4,BF4-中B原子最外层只有3个电子,最多3个共用电子,则BF4-中应含有共价键和配位键;B原子的价层电子对=3+![]() ×2=4,该离子中不含孤电子对,所以BF4-为正四面体结构;
×2=4,该离子中不含孤电子对,所以BF4-为正四面体结构;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为共价键,层间作用力为分子间作用力。

【题目】在实验室中,用下图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中。实验结果与预测的现象一致的是
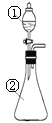
选项 | ①中的物质 | ②中的物质 | 预测②中的现象 |
A. | 氢氧化钠 | 明矾溶液 | 开始时即产生白色沉淀 |
B. | 浓硫酸 | 铜片 | 产生无色气体,溶液变蓝 |
C. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
D. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 开始时无明显现象 |
A.AB.BC.CD.D