��Ŀ����
�ڻ�ѧ��Ӧ�У���Ӧ��ת�����������Ȼ���������ı仯��
��1������˵����ȷ���� ��
��2��101 kPa�����£�������������Ӧ���ɰ����������仯ʾ��ͼ���£�
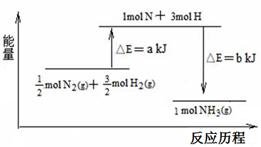
��֪����a=1127����b=1219
��1molN2��3molH2���뷴Ӧ����2molNH3 ������ա��ų��������� KJ��
��1������˵����ȷ���� ��
| A����ѧ�仯�е������仯��Ҫ�ɻ�ѧ���仯����� |
| B�����ȷ�Ӧ����ʱ��һ��Ҫ���ȣ������ȷ�Ӧ����Ҫ���Ȳ��ܷ��� |
| C��������������ʴ�����ⸯʴ�ĸ�����Ӧ��ΪFe��2eһ= Fe2+ |
| D��CaCO3(s) =" CaO(s)" + CO2(g) ��H=" +" 178.5 KJ��mol-1�������DZ�ʾ1mol CaCO3��ȫ�ֽ�����1mol CaO��1mol CO2����Ҫ�ų�178.5 KJ������ |

��֪����a=1127����b=1219
��1molN2��3molH2���뷴Ӧ����2molNH3 ������ա��ų��������� KJ��
��1��A C ��2���ų� 184
�����������1��A����ѧ�仯�з�Ӧ��Ļ�ѧ����������������������Ļ�ѧ���γɷų����������Ի�ѧ�仯�������仯��Ҫ�ɻ�ѧ���仯����ġ���ȷ��B���κλ�ѧ��Ӧ����ʱ���ж��ѻ�ѧ�����������Ĺ��̣�ֻ���еķ�Ӧ����ʱ���յ������ϵͣ��еĽϸߡ����������Ƿ��ȷ�Ӧ�������ȷ�Ӧ��������һ�������²��ܷ���������C��������������ʴ�����ⸯʴ����Fe��������Feʧȥ���ӣ���������������Ӧ��ΪFe��2eһ= Fe2+����ȷ��D��CaCO3(s) =" CaO(s)" + CO2(g) ��H=" +" 178.5 KJ��mol-1�������DZ�ʾ1mol CaCO3��ȫ�ֽ�����1mol CaO��1mol CO2����Ҫ����178.5 KJ������������2�����ݷ�Ӧ�P�����������ʾ��ͼ��֪1molN2��3molH2���뷴Ӧ����2molNH3�ų�����184KJ��

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ

 H��ͬ
H��ͬ 2NH3(g)
2NH3(g) 

 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)

 CO(g)��3H2(g)���÷�Ӧ��H����206 kJ��mol��1��
CO(g)��3H2(g)���÷�Ӧ��H����206 kJ��mol��1��