题目内容
根据四种变化:①Fe(s)→Fe(g);②2H2(g)+ O2(g)=2H2O(g) △H="-482" kJ·mol-1;
③C(s)+CO2(g)=2CO(g);④NaOH(s)=Na+(aq)+OH-(aq)。 请回答下列问题
⑴上述变化中,需要吸收热量的是 (请填变化的代码①②③④,下同)。
⑵上述变化中,体系的混乱度增大的是 。
⑶已知下列两种键能,H-H:436 kJ·mol-1、O-H:463 kJ·mol-1,请计算断裂1 molO2(g)中的共价键需要吸收 kJ的能量。
⑷下面几种说法中。正确的是 [
③C(s)+CO2(g)=2CO(g);④NaOH(s)=Na+(aq)+OH-(aq)。 请回答下列问题
⑴上述变化中,需要吸收热量的是 (请填变化的代码①②③④,下同)。
⑵上述变化中,体系的混乱度增大的是 。
⑶已知下列两种键能,H-H:436 kJ·mol-1、O-H:463 kJ·mol-1,请计算断裂1 molO2(g)中的共价键需要吸收 kJ的能量。
⑷下面几种说法中。正确的是 [
| A.化合反应都大多是放热反应 |
| B.凡是需要加热的反应,都是吸热反应 |
| C.体系的混乱度增大的反应都是吸热反应 |
| D.中和反应是放热反应,其化学能可以转化成电能 |
(1)①③④ (2)①③④ (3)498 (4)A
试题分析:(1)铁由固态变为气态是物理变化,但需要吸热,氢气燃烧是放热反应,碳与CO2反应生成CO的是吸热反应,氢氧化钠电离是吸热过程,所以需要吸收热量的是①③④。
(2)同一种物质在气态是熵值最大,氢气燃烧熵值减小,碳与CO2反应是体积增大的可逆反应,电离过程是熵值增大的,所以上述变化中,体系的混乱度增大的是①③④。
(3)反应热=反应物的键能-生成物的键能,所以根据2H2(g)+ O2(g)=2H2O(g) △H="-482" kJ·mol-1可知,2×436 kJ·mol-1+x-4×463 kJ·mol-1=-482 kJ·mol-1,解得x=498kJ·mol-1,即断裂1 molO2(g)中的共价键需要吸收498的能量。
(4)A、化合反应都大多是放热反应,A正确;B、反应是放热反应还是吸热反应与反应条件无关系,只与反应物总能量和生成物总能量的相对大小有关系,因此凡是需要加热的反应,都是吸热反应是错误的,B不正确;C、体系的混乱度增大的反应不一定都是吸热反应,C不正确;D、中和反应是放热反应,但不是氧化还原反应,因此其化学能不可以转化成电能,D不正确,答案选A。

练习册系列答案
相关题目

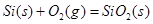 ;
;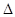 H="-989.2"
H="-989.2" 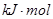
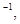 则x的值为 ( )
则x的值为 ( ) 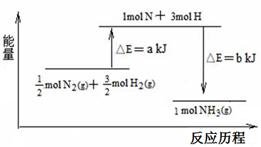
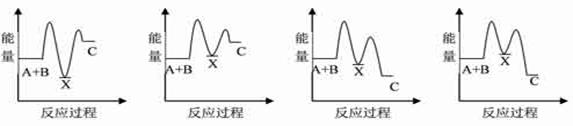
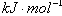
 2SO3(g)
2SO3(g)