题目内容
利用光能和光催化剂,可将 CO2和 H2O(g)转化为 CH4和 O2。紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图所示。

(1)在0~30 小时内,CH4的平均生成速率 vⅠ、vⅡ和vⅢ从大到小的顺序为________;反应开始后的 12 小时内,在第________种催化剂作用下,收集的 CH4最多。
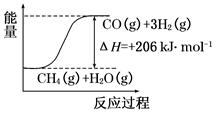
(2)将所得 CH4与 H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)。该反应ΔH=+206 kJ·mol-1。
CO(g)+3H2(g)。该反应ΔH=+206 kJ·mol-1。
①画出反应过程中体系能量变化图(进行必要标注)。
②将等物质的量的CH4和 H2O(g)充入 1 L 恒容密闭反应器中,某温度下反应达到平衡,平衡常数 K = 27,此时测得 CO 的物质的量为 0.10 mol,求CH4的平衡转化率(计算结果保留两位有效数字)。
(3)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-802 kJ·mol-1。
写出由 CO2生成 CO 的热化学方程式____________________________________

(1)在0~30 小时内,CH4的平均生成速率 vⅠ、vⅡ和vⅢ从大到小的顺序为________;反应开始后的 12 小时内,在第________种催化剂作用下,收集的 CH4最多。
(2)将所得 CH4与 H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)
 CO(g)+3H2(g)。该反应ΔH=+206 kJ·mol-1。
CO(g)+3H2(g)。该反应ΔH=+206 kJ·mol-1。①画出反应过程中体系能量变化图(进行必要标注)。
②将等物质的量的CH4和 H2O(g)充入 1 L 恒容密闭反应器中,某温度下反应达到平衡,平衡常数 K = 27,此时测得 CO 的物质的量为 0.10 mol,求CH4的平衡转化率(计算结果保留两位有效数字)。
(3)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-802 kJ·mol-1。
写出由 CO2生成 CO 的热化学方程式____________________________________
(1)vⅢ>vⅡ>vⅠ Ⅱ
(2)①
②91%
(3)CO2(g)+3H2O(g)=CO(g)+3H2(g)+2O2(g)
ΔH=+1008 kJ· mol-1
(2)①

②91%
(3)CO2(g)+3H2O(g)=CO(g)+3H2(g)+2O2(g)
ΔH=+1008 kJ· mol-1
本题考查化学反应速率和化学平衡,意在考查考生的识图能力、三段式解决化学平衡问题能力和盖斯定律的使用。(1)0~30小时内,CH4的平均速率=,由图可知,30小时内CH4的产量Ⅲ>Ⅱ>Ⅰ,即CH4的平均生成速率的关系为vⅢ>vⅡ>vⅠ;前12小时内在第Ⅱ种催化剂作用下,收集的CH4最多。
(2)①该反应中,CH4的用量越多,吸收的热量越多,二者成正比例关系,标注反应热注意二者的对应关系。
②假设CH4和H2O的起始量均为x mol,结合平衡时n(CO)=0.10 mol,有:
CH4(g)+H2O(g)=CO(g)+3H2(g)
起始浓度(mol·L-1) x x 0 0
变化量(mol·L-1) 0.10 0.10 0.10 0.30
平衡浓度(mol·L-1) x-0.10 x-0.10 0.10 0.30
结合K===27,
解得x=0.11 mol·L-1,
CH4的转化率=×100%=91%。
(3)结合题目所给的两个热化学反应方程式,根据盖斯定律,将两方程式作差即可。
(2)①该反应中,CH4的用量越多,吸收的热量越多,二者成正比例关系,标注反应热注意二者的对应关系。
②假设CH4和H2O的起始量均为x mol,结合平衡时n(CO)=0.10 mol,有:
CH4(g)+H2O(g)=CO(g)+3H2(g)
起始浓度(mol·L-1) x x 0 0
变化量(mol·L-1) 0.10 0.10 0.10 0.30
平衡浓度(mol·L-1) x-0.10 x-0.10 0.10 0.30
结合K===27,
解得x=0.11 mol·L-1,
CH4的转化率=×100%=91%。
(3)结合题目所给的两个热化学反应方程式,根据盖斯定律,将两方程式作差即可。

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
 O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ/mol 的说法中,正确的是( )
O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ/mol 的说法中,正确的是( )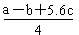
 2SO3(g)
2SO3(g) H2O(l) ΔH="-57.3" kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。其焓变ΔH1、ΔH2、ΔH3的关系是( )
H2O(l) ΔH="-57.3" kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。其焓变ΔH1、ΔH2、ΔH3的关系是( )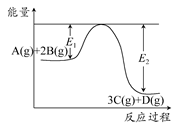
 3C(g)+D(g) ΔH>0
3C(g)+D(g) ΔH>0