题目内容
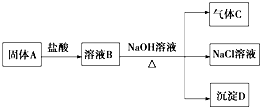
2.如图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.根据以上流程图,下列说法不正确的是( )
| A. | 操作II中,通入硫化氢至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化 | |
| B. | 在溶液中用硫酸酸化至pH=2的目的防止Fe2+沉淀 | |
| C. | 操作Ⅰ所得滤液中可能含有Fe3+ | |
| D. | 常用标准KMnO4溶液滴定的方法测定绿矾产品中Fe2+的含量,滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O |
分析 铁屑(含少量锡、氧化铁等杂质)与稀硫酸反应生成硫酸锡和硫酸亚铁,通过过滤滤去不溶的物质,通过调节溶液的PH并通入硫化氢使锡离子沉淀,过滤除去不溶性的硫化锡,得到硫酸亚铁溶液通过冷却结晶,得到纯净绿矾;
A、通入硫化氢至饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化;
B、根据SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,可知用硫酸酸化后调节溶液PH=2目的是锡离子完全沉淀,亚铁离子不沉淀;
C、稀硫酸是弱氧化剂,只能将铁氧化为亚铁;
D、高锰酸钾是氧化剂,而亚铁离子是还原剂,两者发生氧化还原反应,根据电子得失守恒书写离子反应方程式.
解答 解:铁屑(含少量锡、氧化铁等杂质)与稀硫酸反应生成硫酸锡和硫酸亚铁,通过过滤滤去不溶的物质,通过调节溶液的PH并通入硫化氢使锡离子沉淀,过滤除去不溶性的硫化锡,得到硫酸亚铁溶液通过冷却结晶,得到纯净绿矾;
A、通入硫化氢至饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化,所以通入硫化氢至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化,故A正确;
B、根据SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,而PH=2在1.6和3.0之间,所以锡离子完全沉淀,亚铁离子不沉淀,故B正确;
C、稀硫酸是弱氧化剂,只能将铁氧化为亚铁,不可能生成铁离子,故C错误;
D、高锰酸钾是氧化剂,而亚铁离子是还原剂,两者发生氧化还原反应,根据电子得失守恒,锰由+7→+2,降低5,而铁元素由+2→+3,升高1,所以亚铁离子前面系数为5,再根据原子守恒和电荷守恒,方程式为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,故D正确;
故选C.
点评 本题考查了铁盐亚铁盐的性质应用,分离混合物的实验方法设计和分析判断,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 丙烷、丁烯 | B. | 乙炔、丙烷 | C. | 乙烷、乙烯 | D. | 乙炔、乙烯 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 4 | ⑧ | ⑨ | ⑩ |
(2)在 ①~⑩元素的最高价氧化物的水化物呈两性的是Al(OH)3;⑥形成的最高价氧化物的水化物的分子式是HClO4;
(3)①形成的气态氢化物的结构式是
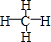 ;其中心原子采取sp3杂化,空间构型为正四面体.
;其中心原子采取sp3杂化,空间构型为正四面体. | A. | 苯酚能和NaOH溶液反应 | |
| B. | 甲苯与液溴,铁作催化剂的反应 | |
| C. | 甲苯能被酸性高锰酸钾氧化 | |
| D. | 1mol邻二甲苯与3mol H2发生加成反应 |
| A. | D2O | B. | NH3 | C. | Cl2 | D. | NaCl |
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 洗涤烧杯和玻璃棒的溶液未转入容量瓶中 | |
| C. | 定容时观察液面俯视 | |
| D. | 定容加水超过刻度线又吸出少量 |
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:
实验装置如图1所示.(固定装置已略去)
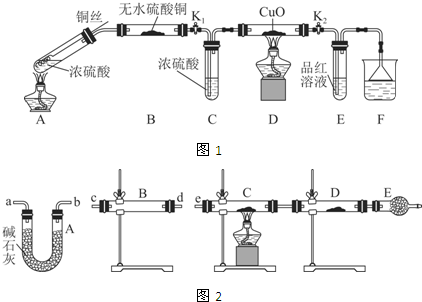
(1)A中反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O.
(2)F烧杯中的溶液通常是NaOH溶液(或酸性KMnO4溶液等).
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E中溶液褪色.
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝.
Ⅱ.研究过量的锌与浓硫酸反应产生的气体:
(1)过量的锌与浓硫酸反应制取的二氧化硫气体中可能含有的杂质是氢气和水蒸气;
(2)某同学用下列装置(如图2)连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是cd(或dc)ab(或ba)e(用a、b…填写).
(3)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下列横线上:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ① | ② | ③ |
| C | CuO固体 | ④ | ⑤ |
| A. | 用干燥洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH | |
| B. | 实验时受溴腐蚀致伤,先用苯或甘油洗伤口,再用水洗 | |
| C. | 可用重结晶法提纯含少量NaCl的KNO3晶体 | |
| D. | 容量瓶、滴定管上都标有使用温度,容量瓶无“O”刻度,滴定管有“O”刻度,使用前水洗后滴定管还需润洗,而容量瓶不需要润洗 |