题目内容
5.燃烧某混合气体,所产生的CO2的质量一定大于燃烧相同质量丙烯所产生的CO2的质量,该混合气体是( )| A. | 丙烷、丁烯 | B. | 乙炔、丙烷 | C. | 乙烷、乙烯 | D. | 乙炔、乙烯 |
分析 烃的燃烧反应中,燃烧相同质量的烃,烃中含碳的质量分数越大,生成的CO2量越多,根据丙烯的分子组成,然后利用极限法根据含碳量高低进行分析.
解答 解:A.丁烯与丙烯的含碳量相同,丙烷的含碳量小于丙烯,所以混合气体的含碳量小于丙烯,所产生CO2的量一定小于燃烧相同质量的丙烯所产生的CO2,故A错误;
B.乙炔的含碳量大于丙烯,丙烷含碳量小于丙烯,所以混合气体中含碳量可能比丙烯大,也可能比丙烯小,也可能相等,所产生CO2的量不一定大于燃烧相同质量的丙烯所产生的CO2,故B错误;
C.乙烯的含碳量与丙烯相同,乙烷的含碳量小于丙烯,所以混合气体的含碳量小于丙烯,质量相等时完全燃烧产生CO2的量一定小于燃烧相同质量的丙烯所产生的CO2,故C错误;
D.乙烯与丙烯的最简式相同,含碳量相同,乙炔的含碳量大于丙烯,所以混合气体的含碳量大于丙烯,所产生CO2的量一定大于燃烧相同质量的丙烯所产生的CO2,故D正确;
故选D.
点评 本题考查了有机化合物化学式的有关计算,题目难度中等,抓住燃烧相同质量的烃,烃中含碳的质量分数越大,生成的CO2量越多,以及利用极限法根据含碳量高低是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.如图图象能正确表示相关反应中产物物质的量(横、纵坐标单位:mol)的变化的是( )
| A. | 图 n(O2)=2mol时,高温下C和O2在密闭容器中的反应产物 n(O2)=2mol时,高温下C和O2在密闭容器中的反应产物 | |
| B. | 图 n(NaOH)=1mol 时,CO2和NaOH溶液反应生成的盐 n(NaOH)=1mol 时,CO2和NaOH溶液反应生成的盐 | |
| C. |  n(HCl)=1mol 时,K2CO3和HCl溶液在敞口容器反应生成的气体 n(HCl)=1mol 时,K2CO3和HCl溶液在敞口容器反应生成的气体 | |
| D. |  n(HNO3)=2mol 时,Fe和稀硝酸反应生成的氧化产物(还原产物为NO) n(HNO3)=2mol 时,Fe和稀硝酸反应生成的氧化产物(还原产物为NO) |
16.实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作精制:①蒸馏 ②水洗 ③用干燥剂干燥 ④用10%的NaOH溶液洗.正确的操作顺序是( )
| A. | ①②③④ | B. | ④②③① | C. | ②④③① | D. | ④①②③ |
13.下列说法正确的是( )
| A. | 光导纤维、合成纤维和人造纤维都是有机高分子化合物 | |
| B. | 合金拓展了金属材料的使用范围,合金中也可能含有非金属元素 | |
| C. | H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 | |
| D. | 对“地沟油”进行分馏可以制得汽油、煤油,达到变废为宝的目的 |
20. 如图是研究铜与浓硫酸的反应装置:
如图是研究铜与浓硫酸的反应装置:
(1)A试管中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)反应一段时间后,可观察到B试管中的现象为溶液由红色变成无色.
(3)C试管口浸有NaOH溶液的棉团作用是吸收Cl2和SO2,防止污染空气.
(4)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是向上拉铜丝,终止反应,冷却后,将A中溶液慢慢倒入盛有少量水的烧杯(试管)里,观察溶液颜色是否为蓝色.
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
仅由上述资料可得出的正确结论是abd.
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol•L
d.硫酸浓度越大,黑色物质越快出现、越难消失.
 如图是研究铜与浓硫酸的反应装置:
如图是研究铜与浓硫酸的反应装置:(1)A试管中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)反应一段时间后,可观察到B试管中的现象为溶液由红色变成无色.
(3)C试管口浸有NaOH溶液的棉团作用是吸收Cl2和SO2,防止污染空气.
(4)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是向上拉铜丝,终止反应,冷却后,将A中溶液慢慢倒入盛有少量水的烧杯(试管)里,观察溶液颜色是否为蓝色.
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
| 资料1 |
| ||||||||||||
| 资料2 | X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种. |
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol•L
d.硫酸浓度越大,黑色物质越快出现、越难消失.
10.下列电离方程式书写正确的是( )
| A. | Al2(SO4)3═Al23++3SO42- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHCO3═Na++H++CO32- | D. | Na3PO4═3Na++PO43- |
14.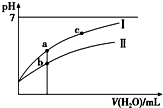 已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
 已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( ) | CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
2.如图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.根据以上流程图,下列说法不正确的是( )

已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.根据以上流程图,下列说法不正确的是( )
| A. | 操作II中,通入硫化氢至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化 | |
| B. | 在溶液中用硫酸酸化至pH=2的目的防止Fe2+沉淀 | |
| C. | 操作Ⅰ所得滤液中可能含有Fe3+ | |
| D. | 常用标准KMnO4溶液滴定的方法测定绿矾产品中Fe2+的含量,滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O |