题目内容
3.下列有关实验事实中,能说明侧链对苯环性质有影响的是( )| A. | 苯酚能和NaOH溶液反应 | |
| B. | 甲苯与液溴,铁作催化剂的反应 | |
| C. | 甲苯能被酸性高锰酸钾氧化 | |
| D. | 1mol邻二甲苯与3mol H2发生加成反应 |
分析 A、苯酚具有弱酸性,能和碱反应生成盐和水;
B、苯也能发生取代反应;
C、苯、甲烷不能被酸性KMnO4溶液氧化,甲苯能被酸性KMnO4溶液氧化为苯甲酸,据此解答即可;
D、苯也能与氢气发生加成反应.
解答 解:A、苯酚能和NaOH溶液反应,说明苯酚具有弱酸性,能和碱反应生成盐和水,不能说明苯环对侧链性质有影响,故A错误;
B、苯也能发生取代反应,故甲苯与液溴,铁作催化剂的反应不能说明侧链对苯环性质有影响,故B错误;
C、甲苯可看作是CH4中的1个H原子被-C6H5取代,苯、甲烷不能被酸性KMnO4溶液氧化使其褪色,甲苯能被酸性KMnO4溶液氧化为苯甲酸,苯环未变化,侧链甲基被氧化为羧基,说明苯环影响甲基的性质,故C正确;
D、苯、甲苯都能能与H2发生加成反应,是苯环体现的性质,不能说明苯环对侧链性质产生影响,故D错误,故选C.
点评 本题考查学生苯酚的化学性质,关键是要从侧链对苯环性质的影响以及苯环对侧链性质的影响来理解把握,较简单.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
13.下列说法正确的是( )
| A. | 光导纤维、合成纤维和人造纤维都是有机高分子化合物 | |
| B. | 合金拓展了金属材料的使用范围,合金中也可能含有非金属元素 | |
| C. | H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 | |
| D. | 对“地沟油”进行分馏可以制得汽油、煤油,达到变废为宝的目的 |
14.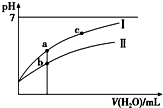 已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
 已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( ) | CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
18.天然提取和人工合成的有机物往往是混合物,假设给你一份有机混合物让你进行研究,一般要采取的几个步骤是( )
| A. | 分离、提纯→确定分子式→确定实验式→确定结构式 | |
| B. | 分离、提纯→确定实验式→确定分子式→确定结构式 | |
| C. | 分离、提纯→确定结构式→确定实验式→确定分子式 | |
| D. | 确定分子式→确定实验式→确定结构式→分离、提纯 |
8.下列结论是从某同学的笔记本上摘录的,你认为其中肯定正确的是( )
①微粒半径Cl->S2->S>F ②氢化物的稳定性 HF>HCl>H2S>H2Se ③还原性S2->Cl->Br->I- ④氧化性 Cl2>S>Se>Te ⑤酸性 H2SO4>HClO4>H2SeO4 ⑥得电子能力F>Cl>Br>I.
①微粒半径Cl->S2->S>F ②氢化物的稳定性 HF>HCl>H2S>H2Se ③还原性S2->Cl->Br->I- ④氧化性 Cl2>S>Se>Te ⑤酸性 H2SO4>HClO4>H2SeO4 ⑥得电子能力F>Cl>Br>I.
| A. | 只有① | B. | ①③④ | C. | ②④⑥ | D. | 只有⑥ |
2.如图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.根据以上流程图,下列说法不正确的是( )

已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.根据以上流程图,下列说法不正确的是( )
| A. | 操作II中,通入硫化氢至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化 | |
| B. | 在溶液中用硫酸酸化至pH=2的目的防止Fe2+沉淀 | |
| C. | 操作Ⅰ所得滤液中可能含有Fe3+ | |
| D. | 常用标准KMnO4溶液滴定的方法测定绿矾产品中Fe2+的含量,滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O |
19.“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如图1:

①在其他条件不变时,请在图2中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图.
②某温度下,将2.0mol CO2(g)和6.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图3示,关于温度和压强的关系判断正确的是BD.
A.P3>P2,T3>T2 B.P1>P3,T1>T3 C.P2>P4,T4>T2 D.P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
该反应的平衡常数的表达式为:$\frac{c({H}_{2})×(C{O}_{2})}{c(CO)×c({H}_{2}O)}$;该反应的正反应方向是放热反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的浓度均为0.020mol•L-1,在该条件下CO的平衡转化率为75%.
(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如图1:

①在其他条件不变时,请在图2中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图.
②某温度下,将2.0mol CO2(g)和6.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图3示,关于温度和压强的关系判断正确的是BD.
A.P3>P2,T3>T2 B.P1>P3,T1>T3 C.P2>P4,T4>T2 D.P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
20.下列有关的实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 无色溶液中滴加氯水和CCl4,振荡、静置 | 上层溶液显紫色 | 原溶液中有I- |
| B | 将SO2通入酸性KMnO4溶液中 | 紫色褪去 | SO2具有还原性 |
| C | 向明矾溶液中通入过量氨气 | 先产生大量白色沉淀,后沉淀逐渐消失 | Al(OH)3能溶于氨水 |
| D | AgI沉淀中滴入浓KCl溶液 | 有白色沉淀出现 | 溶解度:AgCl<AgI |
| A. | A | B. | B | C. | C | D. | D |
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.