题目内容
7.配制一定物质的量浓度的KOH溶液时,下列操作对实验结果没有影响的( )| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 洗涤烧杯和玻璃棒的溶液未转入容量瓶中 | |
| C. | 定容时观察液面俯视 | |
| D. | 定容加水超过刻度线又吸出少量 |
分析 分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{V}$判断对溶液浓度的影响.
解答 解:A、溶液配制需加水定容,容量瓶中有少量的蒸馏水,对所配溶液浓度无影响,故A正确;
B、洗涤烧杯和玻棒的溶液未转入容量瓶中,移入容量瓶内氢氧化钾的质量减少,所配溶液浓度偏低,故B错误;
C、定容时观察液面俯视,所配溶液体积偏小,导致所配溶液浓度偏高,故C错误;
D、定容加水超过刻度线,又吸出少量或导致吸出少量的溶质,所以溶质质量减小,导致所配溶液浓度偏小,故D错误.
故选A.
点评 本题考查配制一定物质的量浓度的溶液的实验操作误差分析,题目难度中等,分析时注意从c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断.

练习册系列答案
相关题目
10.下列电离方程式书写正确的是( )
| A. | Al2(SO4)3═Al23++3SO42- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHCO3═Na++H++CO32- | D. | Na3PO4═3Na++PO43- |
8.下列结论是从某同学的笔记本上摘录的,你认为其中肯定正确的是( )
①微粒半径Cl->S2->S>F ②氢化物的稳定性 HF>HCl>H2S>H2Se ③还原性S2->Cl->Br->I- ④氧化性 Cl2>S>Se>Te ⑤酸性 H2SO4>HClO4>H2SeO4 ⑥得电子能力F>Cl>Br>I.
①微粒半径Cl->S2->S>F ②氢化物的稳定性 HF>HCl>H2S>H2Se ③还原性S2->Cl->Br->I- ④氧化性 Cl2>S>Se>Te ⑤酸性 H2SO4>HClO4>H2SeO4 ⑥得电子能力F>Cl>Br>I.
| A. | 只有① | B. | ①③④ | C. | ②④⑥ | D. | 只有⑥ |
2.如图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.根据以上流程图,下列说法不正确的是( )

已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.根据以上流程图,下列说法不正确的是( )
| A. | 操作II中,通入硫化氢至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化 | |
| B. | 在溶液中用硫酸酸化至pH=2的目的防止Fe2+沉淀 | |
| C. | 操作Ⅰ所得滤液中可能含有Fe3+ | |
| D. | 常用标准KMnO4溶液滴定的方法测定绿矾产品中Fe2+的含量,滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O |
19.“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如图1:

①在其他条件不变时,请在图2中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图.
②某温度下,将2.0mol CO2(g)和6.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图3示,关于温度和压强的关系判断正确的是BD.
A.P3>P2,T3>T2 B.P1>P3,T1>T3 C.P2>P4,T4>T2 D.P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
该反应的平衡常数的表达式为:$\frac{c({H}_{2})×(C{O}_{2})}{c(CO)×c({H}_{2}O)}$;该反应的正反应方向是放热反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的浓度均为0.020mol•L-1,在该条件下CO的平衡转化率为75%.
(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如图1:

①在其他条件不变时,请在图2中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图.
②某温度下,将2.0mol CO2(g)和6.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图3示,关于温度和压强的关系判断正确的是BD.
A.P3>P2,T3>T2 B.P1>P3,T1>T3 C.P2>P4,T4>T2 D.P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
17.生活中处处有化学,下列叙述错误的是( )
| A. | 用燃烧法可鉴别羊毛制品相涤纶制品 | |
| B. | 保鲜膜、一次性食品袋的主要成分是聚氯乙烯 | |
| C. | 严禁乱弃废电池,防止重金属污染土壤和水源 | |
| D. | 某些食品的包装袋内常放人一小包生石灰作干燥剂 |
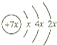 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.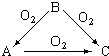 常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.
常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.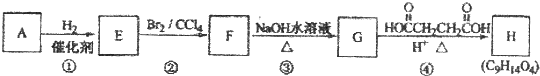
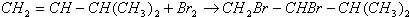 ;
;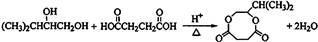 .
.