题目内容
【题目】下列实验操作正确且能达到相应目的的是
选项 | 实验目的 | 实验操作 |
A | 称取2.0gNaOH固体 | 先在托盘上各放1张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
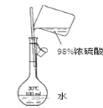
B | 配制稀硫酸 | 先将浓硫酸加入烧杯,后倒入蒸馏水 |
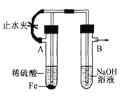
C | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没 |
D | 检验溶液中是否有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
A. A B. B C. C D. D
【答案】D
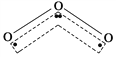
【解析】分析:A项,NaOH具有强腐蚀性,应用玻璃器皿称量NaOH固体;B项,稀释浓硫酸时应“酸入水中”;C项,盐酸具有强酸性,用盐酸浸没铁钉验证铁的析氢腐蚀;D项,检验NH4+的原理是NH4++OH-![]() NH3↑+H2O,NH3能使湿润的红色石蕊试纸变蓝。
NH3↑+H2O,NH3能使湿润的红色石蕊试纸变蓝。
详解:A项,NaOH具有强腐蚀性,不能用滤纸称量NaOH固体,应用玻璃器皿(如烧杯等)称量NaOH固体,A项错误;B项,浓硫酸的密度比水大得多,直接将水加入浓硫酸会使水浮在浓硫酸表面,大量放热而使酸液沸腾溅出造成事故,稀释浓硫酸时应将浓硫酸沿器壁慢慢注入水中,并不断搅拌,使稀释产生的热量及时散出,B项错误;C项,钢铁在中性或酸性很弱的溶液中发生吸氧腐蚀,盐酸具有强酸性,用盐酸浸没铁钉验证铁的析氢腐蚀,C项错误;D项,检验NH4+的原理是NH4++OH-![]() NH3↑+H2O,NH3能使湿润的红色石蕊试纸变蓝,检验NH4+的实验操作为:取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体,若试纸变蓝,则原试液中含NH4+,D项正确;答案选D。
NH3↑+H2O,NH3能使湿润的红色石蕊试纸变蓝,检验NH4+的实验操作为:取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体,若试纸变蓝,则原试液中含NH4+,D项正确;答案选D。

【题目】粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是燃煤发电过程中产生的废渣。粉煤灰的综合利用具有很大的价值。
(1)煤炭在火炉中燃烧很旺时,在往炉膛内的热煤炭上喷洒少量水的瞬间,炉子内火会更旺。如果烧去同量的煤炭,喷洒过水的和没有喷洒过水的煤炭相比较,它们放出的总热量___(填“相同”或“不相同”)。这是因为:________________________。
(2)研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究。
①以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离。向分离所得的滤液中加入还原剂使Fe3+转化为Fe2+,结合下表分析其原因:___________________
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~895 | 1.94~3.20 | 3.69~4.8 |
②使用碱性较弱的氨水为pH调节剂,进行分离实验。反应终点的pH对铝和铁分离效果的影响如图1。根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是____________。
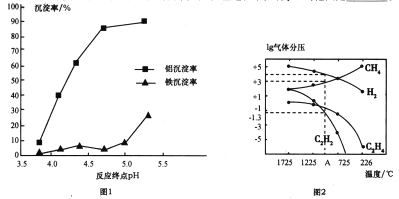
(3)工业上可利用煤的气化产物(水煤气)合成甲烷研究得出,甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图2所示。
①T℃时,向1L恒容密闭容器中充入0.3molCH4只发生反应2CH4(g)![]() C2H4(g)+2H2(g)。达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H___(填“>”或“<”)0,CH4的平衡转化率为________。
C2H4(g)+2H2(g)。达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H___(填“>”或“<”)0,CH4的平衡转化率为________。
②列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数Kp=________(用平衡分压代替平衡浓度列式计算,不要求写单位,lg0.05=-1.3)。
C2H2(g)+3H2(g)在图中A点温度时的平衡常数Kp=________(用平衡分压代替平衡浓度列式计算,不要求写单位,lg0.05=-1.3)。