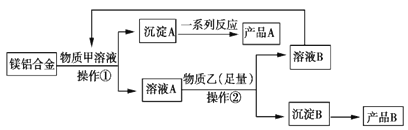
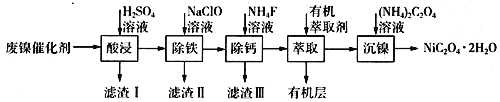
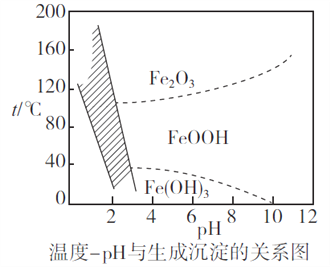
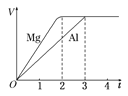
题目内容
【题目】(1)CH、CH3、CH都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH中四个原子是共平面的,三个键角相等,则键角应是________。
(2)叠氮化合物在化学工业上有重要应用。N叫做叠氮离子,请写出3种由三个原子构成的含有与N的电子数相同的粒子的化学式______、______、______。
(3)N≡N键的键能为946 kJ/mol,N—N键的键能为193 kJ/mol,说明N2中的________键比________键稳定(填“σ”或“π”)
(4)CaC2中C![]() 与O
与O![]() 互为等电子体,O
互为等电子体,O![]() 的电子式可表示为________________;1 mol O
的电子式可表示为________________;1 mol O![]() 中含有的π键数目为________。
中含有的π键数目为________。
(5)PH3在常温下是一种无色、剧毒、易自燃的气体,分子结构和NH3相似。在常温下1体积的水能溶解0.26体积的PH3,PH3和卤化氢(HX)作用生成相应的化合物PH4X,PH4X在水溶液中完全水解(PH结构类似于CH4)。PH3的分子结构的形状是________;在PH中P-H键之间的夹角是_____。
【答案】 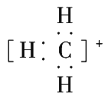
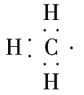
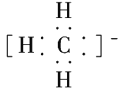 120° CO2 N2O BeF2 π σ
120° CO2 N2O BeF2 π σ ![]() 2NA 三角锥形 109.5°
2NA 三角锥形 109.5°
【解析】本题主要考查分子结构。
(1)CH、CH3、CH都是重要的有机反应中间体,它们的电子式分别是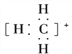 、
、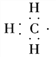 、
、 ;其中CH中四个原子是共平面的,三个键角相等,则键角应是120°。
;其中CH中四个原子是共平面的,三个键角相等,则键角应是120°。
(2) N含有22个电子,3种由三个原子构成的含有与N的电子数相同的粒子的化学式为CO2、N2O、BeF2。
(3)N≡N键的键能为946 kJ/mol,N—N键的键能为193 kJ/mol,946>193×3=579,说明N2中的π键比σ键稳定。
(4)CaC2中C![]() 与O
与O![]() 互为等电子体,O
互为等电子体,O![]() 的电子式与C
的电子式与C![]() 相似,可表示为
相似,可表示为![]() ;1 mol O
;1 mol O![]() 中含有的π键数目为2NA。
中含有的π键数目为2NA。
(5)PH3的分子结构和NH3相似,形状是三角锥形;在PH中P-H键之间的夹角是109.5°。

 名校课堂系列答案
名校课堂系列答案【题目】下列实验操作正确且能达到相应目的的是
选项 | 实验目的 | 实验操作 |
A | 称取2.0gNaOH固体 | 先在托盘上各放1张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
B | 配制稀硫酸 | 先将浓硫酸加入烧杯,后倒入蒸馏水 |
C | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没 |
D | 检验溶液中是否有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
A. A B. B C. C D. D