题目内容
3.某化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
(1)实验室制备Cl2依据的原理是(化学方程式):MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+2H2O+Cl2↑,应选用上图A、E装置中的E(填序号)制Cl2,反应中浓盐酸所表现出的性质是酸性、还原性.
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是溶液由无色变为红色.
(3)NaOH溶液与Cl2反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色.查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是Cl2+SO2+2H2O=H2SO4+2HCl.
分析 (1)二氧化锰与浓盐酸在加热条件下生成氯气;根据反应物的状态和反应条件选择反应装置,根据氯元素的化合价判断其表现的性质;
(2)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,注意次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;
(3)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(4)氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应而使气体失去漂白性.
解答 解:(1)二氧化锰与浓盐酸在加热条件下生成氯气,其反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;实验室制取氯气所用药品是固体和液体,反应条件是加热,所以应选用固液加热型装置,故选E;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中HCl生成MnCl2,氯元素化合价不变,由HCl生成Cl2,氯元素化合价降低,所以浓盐酸所表现出的性质是酸性和还原性,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;E;酸性、还原性;
(2)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质生成无色物质,次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;加热时,次氯酸漂白过的溶液无变化,二氧化硫和有色物质生成的无色物质不稳定,加热时能重新变成红色,
故答案为:溶液由无色变成红色;
(3)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应而使气体失去漂白性,反应方程式为Cl2+SO2+2H2O=H2SO4+2HCl,
故答案为:Cl2+SO2+2H2O=H2SO4+2HCl.
点评 本题考查了次氯酸和二氧化硫的漂白性,难度不大,注意次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的,其漂白原理也不同.

| A. | 完全燃烧产物只有二氧化碳和水 | |
| B. | 它们几乎不溶于水 | |
| C. | 分子的通式为CnH2n+2,与氯气发生取代反应 | |
| D. | 它们完全由碳氢元素组成 |
| A. | 大于14NA | B. | 等于14NA | C. | 小于14NA | D. | 无法确定 |
| A. | CO和N2 | B. | O3和SO2 | C. | CO2和N2O | D. | N2H4和C2H4 |
| A. | 淀粉、蛋白质均属于高分子化合物,油脂不属于高分子化合物 | |
| B. | 乙醇的分子式为C2H6O,常温下是一种无色液体,密度比水小 | |
| C. | 乙酸的结构简式是CH3COOH,能和水以任意比互溶,酸性比碳酸强 | |
| D. | 乙烯是重要的化工原料,能使溴水和酸性高锰酸钾溶液褪色,具有漂白作用 |
| A. | 把少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═2HClO+CaSO3↓ | |
| B. | 足量铁屑溶于稀硫酸:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-═CO32-+H2O | |
| D. | 铝片溶于烧碱溶液:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
| A. | 液化石油气(LPG)的主要成份是碳氢化合物 | |
| B. | 光化学烟雾是氮氧化物和烃的排放引发的环境污染 | |
| C. | CHCl3不存在同分异构体,可以证明甲烷是以碳原子为中心的正四面体结构 | |
| D. | 甲烷与二氧化碳一样,也是一种温室气体 |
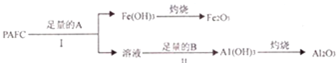
 ,Y与W形成的原子个数比为1:1的化合物的电子式是
,Y与W形成的原子个数比为1:1的化合物的电子式是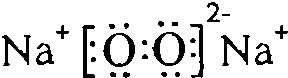 .
.