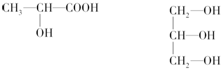题目内容
7.足量锌投入到1L14mol/L浓硫酸中充分反应,经测定没有硫酸剩余,则此过程转移的电子数( )| A. | 大于14NA | B. | 等于14NA | C. | 小于14NA | D. | 无法确定 |
分析 开始Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,由反应方程式可知2mol硫酸转移的是2个电子,当浓硫酸变成稀硫酸,发生反应Zn+H2SO4=ZnSO4+H2↑,1mol硫酸对应2个电子,由此分析解答.
解答 解:开始Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,由反应方程式可知2mol硫酸转移的是2个电子,当浓硫酸变成稀硫酸,发生反应Zn+H2SO4=ZnSO4+H2↑,1mol硫酸对应2个电子,经测定没有硫酸剩余,所以硫酸完全反应,而1L14mol/L浓硫酸转移电子数大于14mol小于28mol,即此过程转移的电子数大于14NA,故选A.
点评 本题考查方程式的相关计算,难度中等,注意浓硫酸和稀硫酸性质的不同,判断转移电子的数目是解题关键.

练习册系列答案
相关题目
17.下列化学式只能表示一种纯净物的是( )
| A. | CHFBrI | B. | C2H4O2 | C. | C6H12O6 | D. | CF2Cl2 |
18.“绿色化学”对化学反应提出了“原子经济性”的新概念及要求.理想的原子经济性是原料分子中的原子全部转化为所需要的产物,不产生副产物,实现零排放.下列反应过程一定符合这一要求的是( )
| A. | 甲烷→一氯甲烷 | B. | 氯乙烯→聚氯乙烯 | ||
| C. | 乙醇→乙醛 | D. | 对苯二甲酸,乙二醇→聚酯纤维 |
15.以下物质一定条件下可与水反应的是( )
| A. | Fe | B. | Al(OH)3 | C. | NO | D. | H2SO3 |
2.下列反应属于取代反应的是( )
| A. | 在光照条件下甲烷和氯气生成一氯甲烷的反应 | |
| B. | 乙醇和酸性高锰酸钾溶液的反应 | |
| C. | 乙烯和溴的四氯化碳溶液的反应 | |
| D. | 镍作催化剂、加热的条件下苯和氢气的反应 |
6.萘(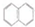 )一氯代物的同分异构体有( )
)一氯代物的同分异构体有( )
 )一氯代物的同分异构体有( )
)一氯代物的同分异构体有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
 ,电子排布式1s22s22p63s23p63d14s2.该元素的原子序数为21,该元素是金属元素(填“金属”或“非金属”),形成的单质为金属晶体.
,电子排布式1s22s22p63s23p63d14s2.该元素的原子序数为21,该元素是金属元素(填“金属”或“非金属”),形成的单质为金属晶体.