题目内容
6. 三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]•3H2O是翠绿色单斜晶体,常温下溶解度为4.7g/100g水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料.实验室制备三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]•3H2O的相关反应为:
三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]•3H2O是翠绿色单斜晶体,常温下溶解度为4.7g/100g水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料.实验室制备三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]•3H2O的相关反应为:(NH4)2Fe(SO4)2•6H2O+H2C2O4═FeC2O4•2H2O↓+(NH4)2SO4+H2SO4+4H2O
2FeC2O4•2H2O+H2O2+3K2C2O4+H2C2O4═2K3[Fe(C2O4)3]•3H2O↓
实验步骤如下:I.称取5.0g(NH4)2Fe(SO4)2•6H2O(s)置于150mL烧杯中,加入15mL去离子水和数滴3mol•L-1的H2SO4 溶液,加热溶解.
Ⅱ.在步骤I制备的溶液中加入25mL饱和H2C2O4溶液,搅拌并加热煮沸,形成黄色FeC2O4•2H2O沉淀.倾析法弃去上层清液并用去离子水洗涤沉淀2~3次.
Ⅲ.在上述沉淀中加入10mL饱和K2C2O4溶液,水浴加热至40°C,慢慢加进20mL3%H2O2溶液,不断搅拌并维持温度在40°C左右,使Fe(Ⅱ)充分氧化为Fe(Ⅲ).滴加完毕后,加热溶液至沸以除去过量的H2O2.IV.保持上述沉淀近沸状态,先加入饱和H2C2O4溶液7mL,然后趁热再滴加饱和H2C2O4溶液1~2mL使沉淀溶解.控制溶液的pH=4~5,此时溶液为翠绿色,趁热过滤,并使滤液控制在30mL左右(若体积太大,可水浴加热浓缩),滤液中加入10mL95%乙醇.用表面皿将烧杯盖好,在暗处放置1~2h冷却结晶、抽滤,用95%乙醇洗涤晶体2次,以除去晶体表面附着的水分,缩短干燥时间.将产品避光保存.
回答下列问题:
(1)步骤Ⅰ中加入数滴3mol•L-1的H2SO4溶液,其目的是抑制Fe2+水解;
(2)步骤Ⅱ中弃去上层清液和洗涤时都采用倾析法.适用倾析法分离的沉淀应具备的条件是沉淀的颗粒较大,静置后容易沉降至容器底部,该步骤中沉淀洗净的标准是在最后一次洗涤液中检测不到SO42-;
(3)步骤Ⅲ中需维持温度在40°C左右的原因是温度太低,Fe2+氧化速度太慢,温度太高容易导致H2O2分解,影响Fe2+氧化,为了监控反应进度,吸取1滴所得的黄色悬浊液于白色点滴板中,加酸酸化后加少许K3[Fe(CN)6]固体,如出现绿色证明Fe2+还没有(填“已经”或“还没有”)完全氧化;
(4)步骤IV中的有关问题:
①加入饱和H2C2O4溶液的目的是为了溶解Fe(OH)3(填化学式)沉淀,H2C2O4溶液应逐滴加入,控制溶液的pH=4~5,pH过高,沉淀溶解不完全,pH过低,会发生副反应,使产品中混有黄色的FeC2O4•2H2O,而且若H2C2O4过量太多容易形成H2C2O4晶体析出,导致产率偏高(填“偏高”、“偏低”或“无影响”);
②趁热过滤时,可将滤纸折叠成菊花形(如图),其目的是加快过滤速度,滤液中加入10mL95%乙醇的目的是降低三草酸合铁(Ⅲ)酸钾的溶解度,促使析出;
(5)K3[Fe(C2O4)3]•3H2O对光敏感,进行下列光化学反应:2[Fe(C2O4)3]3-$\stackrel{光照}{→}$FeC2O4+3C2O42-+2CO2↑简要说明这一性质在工程设计中的应用摄影、晒图、印刷等.
分析 实验室制备三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]•3H2O:硫酸亚铁铵与草酸反应制备出难溶的草酸亚铁,然后在草酸钾和草酸的存在下,用过氧化氢将草酸亚铁氧化为三草酸合铁(Ⅲ)酸钾,加入乙醇后,晶体便从溶液中析出.
(1)步骤Ⅰ中:亚铁离子在水溶液中水解,加入稀硫酸抑制水解;
(2)步骤Ⅱ中:沉淀颗粒较大,静止后容易沉降至试管底部,常用倾析法分离;沉淀表面附有溶液中的硫酸根离子,沉淀洗净的标准是在最后一次洗涤液中检测不到该离子;
(3)步骤Ⅲ中:温度高低影响反应速率,温度高反应快,温度低反应慢,加过氧化氢氧化亚铁离子,但温度高过氧化氢易分解;蓝色和黄色混合色为绿色;
(4)步骤IV中:①加入饱和H2C2O4溶液的目的是为了溶解Fe(OH)3,此时溶液呈翠绿色;若H2C2O4过量太多容易形成H2C2O4晶体析出,H2C2O4晶体误认为产物,导致产率偏高;
②将滤纸折叠成菊花形可加快过滤速度,三草酸合铁(Ⅲ)酸钾难溶于乙醇,滤液中加入10mL95%乙醇的目的是降低三草酸合铁(Ⅲ)酸钾的溶解度,促使析出;
(5)K3[Fe(C2O4)3]•3H2O对光敏感,工程设计中可嗮图、拍照、蓝色印刷等.
解答 解:(1)步骤Ⅰ中:亚铁离子在水溶液中水解:Fe2++2H2O?Fe(OH)2+2H+,溶解的过程中要加入几滴稀硫酸,目的是抑制Fe2+水解,
故答案为:抑制Fe2+水解;
(2)步骤Ⅱ中:在步骤I制备的溶液中加入25mL饱和H2C2O4溶液,搅拌并加热煮沸,晶体颗粒长大形成黄色FeC2O4•2H2O沉淀,沉淀的结晶颗粒较大易沉降至容器底部,适用于采用倾析法分离或洗涤沉淀,所以弃去上层清液和洗涤时都采用倾析法,倒出液体时并用玻璃棒引流,防止溅出液体,生成的FeC2O4•2H2O晶体表面容易粘着硫酸盐,要用少量H2O洗涤,洗净的标准是洗涤液中检不到SO42-,所以该步骤中沉淀洗净的标准是在最后一次洗涤液中检测不到SO42-,
故答案为:沉淀的颗粒较大,静置后容易沉降至容器底部;SO42-;
(3)步骤Ⅲ中:温度太高双氧水容易分解,温度太低Fe2+氧化反应速率太慢,所以在不断搅拌下慢慢滴加H2O2且需水浴保持恒温40℃,吸取1滴所得的黄色的悬浊液于白色点滴板中,加酸酸化后加少许K3[Fe(CN)6]固体,如出现蓝色和黄色混合色绿色,证明还有Fe(II),需再加H2O2至检测不到Fe(II),
故答案为:温度太低,Fe2+氧化速度太慢,温度太高容易导致H2O2分解,影响Fe2+氧化;还没有;
(4)①步骤IV中:在过量草酸根存在下,用过氧化氢氧化草酸亚铁即可得到三草酸合铁(Ⅲ)酸钾,同时有氢氧化铁生成,①加入饱和H2C2O4溶液的目的是为了溶解Fe(OH)3,若H2C2O4过量太多容易形成H2C2O4晶体析出,H2C2O4晶体误认为产物,导致产率偏高,
故答案为:Fe(OH)3;偏高;
②将滤纸折叠成菊花形待过滤的容积增大,可加快过滤速度,三草酸合铁(Ⅲ)酸钾难溶于乙醇,滤液中加入10mL95%乙醇的目的是降低三草酸合铁(Ⅲ)酸钾的溶解度,促使析出,
故答案为:加快过滤速度;降低三草酸合铁(Ⅲ)酸钾的溶解度,促使析出;
(5)K3[Fe(C2O4)3]•3H2O对光敏感,这一性质在工程设计中的应用中可摄影、晒图、印刷等,
故答案为:摄影、晒图、印刷等.
点评 本题考查了物质制备实验过程分析判断,为高频考点,把握发生的化学反应及实验操作为解答的关键,侧重分析能力的考查,注意信息与所学知识的结合,题目难度较大.

 阅读快车系列答案
阅读快车系列答案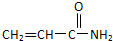
关于丙烯酰胺有下列叙述:①能使酸性KMnO4溶液褪色;②能发生加聚反应生成高分子化合物只③有4种同分异构体;④能与氢气发生加成反应.其中正确的是( )
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②④ |
 为实现“绿色化学实验”进课堂,某化学教师将钠与氯气反应的装置作如下改进:将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述中,错误的是( )
为实现“绿色化学实验”进课堂,某化学教师将钠与氯气反应的装置作如下改进:将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述中,错误的是( )| A. | 白烟中的固体小颗粒是氯化钠晶体 | |
| B. | 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免污染空气 | |
| C. | 钠在氯气中着火燃烧产生苍白色火焰 | |
| D. | 发生的反应为2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl. |
| A. | pH=7的溶液 | |
| B. | [H+]=[OH-]=10-6mol/L的溶液 | |
| C. | 由强酸、强碱等物质的量反应得到的溶液 | |
| D. | 非电解质溶于水得到的溶液 |
| A. | $\frac{2b-c}{a}$mol/L | B. | $\frac{2b-4c}{a}$mol/L | C. | $\frac{b-2c}{a}$mol/L | D. | $\frac{b-4a}{a}$mol/L |