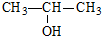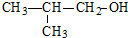题目内容
16.把aL含硫酸铵、硝酸铵的溶液分成两等份,一份用b mol烧碱刚好把NH4+转化为NH3,另一份与氯化钡溶液完全反应消耗c mol BaCl2.则原溶液中NO3-的浓度为( )| A. | $\frac{2b-c}{a}$mol/L | B. | $\frac{2b-4c}{a}$mol/L | C. | $\frac{b-2c}{a}$mol/L | D. | $\frac{b-4a}{a}$mol/L |
分析 bmol烧碱刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知每份中含有bmolNH4+,与氯化钡溶液完全反应消耗cmolBaCl2,根据Ba2++SO42-═BaSO4↓可知每份含有SO42-cmol.根据溶液不显电性,计算出每份中NO3-的物质的量,再根据c=$\frac{n}{V}$进行计算.
解答 解:bmol烧碱刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知每份中含有bmolNH4+,与氯化钡溶液完全反应消耗cmolBaCl2,根据Ba2++SO42-═BaSO4↓可知每份含有SO42-cmol.令每份中NO3-的物质的量为n,根据溶液不显电性,则:bmol×1=cmol×2+n×1,
解得:n=(b-2c)mol,
每份溶液的体积为0.5aL,所以每份溶液硝酸根的浓度为c(NO3-)=$\frac{(b-2c)mol}{0.5aL}$=$\frac{2b-4c}{a}$mol/L,
溶液具有均一性,则原溶液中硝酸根的浓度为$\frac{2b-4c}{a}$mol/L,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度中等,关键明确每份溶液中离子的物质的量浓度与原溶液的关系及溶液中的电荷守恒,试题培养了学生的灵活应用能力.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
7.为了除去CO2中少量的HCl气体,最好将混合气体通过( )
| A. | 浓硫酸 | B. | NaHCO3饱和溶液 | C. | NaOH溶液 | D. | Na2CO3溶液 |
4.短周期5种元素A、B、C、D、E位于同一周期,A和B的最高价氧化物对应的水化物呈碱性,且碱性B>A;C和D的最高价氧化物对应的水化物呈酸性,且酸性C>D;E的最高价氧化物对应的水化物既可与强酸又可与强碱反应,则它们的原子序数由大到小的顺序是( )
| A. | C、D、E、A、B | B. | E、C、D、A、B | C. | B、A、E、D、C | D. | B、A、D、C、E |
11.下列除去杂质的操作方法正确的是( )
| A. | NO中有少量的NO2:用水洗涤后再干燥 | |
| B. | 食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干 | |
| C. | N2中有少量的O2:通过足量灼热的氧化铜 | |
| D. | 硝酸中溶有少量NO2,可向硝酸中加入少量水,使NO2与水反应生成硝酸 |
1.某主族元素的离子X2+有6个电子层,最外层有2个电子,当把XO2溶于浓盐酸时,有黄绿色气体产生,则下列说法正确的是( )
| A. | X2+具有强氧化性 | B. | X的最高正价为+2价 | ||
| C. | XO2具有强氧化性 | D. | 该元素是ⅡA族 |
5.乙烷、乙烯、乙炔共同具有的性质是( )
| A. | 都不溶于水 | |
| B. | 能够使溴水和酸性高锰酸钾溶液褪色 | |
| C. | 分子中各原子都处在同一平面上 | |
| D. | 都能发生聚合反应生成高分子化合物 |
6.若在恒温恒容的容器内进行反应C(s)+H2O(g)?CO(g)+H2(g).则可用来判断该反应达到平衡状态的标志有( )
| A. | 容器中H2O浓度与CO浓度相等 | |
| B. | 容器中H2浓度与CO浓度相等 | |
| C. | 容器中混合气体的密度保持不变 | |
| D. | CO的生成速率与H2O的消耗速率相等 |
 三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]•3H2O是翠绿色单斜晶体,常温下溶解度为4.7g/100g水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料.实验室制备三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]•3H2O的相关反应为:
三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]•3H2O是翠绿色单斜晶体,常温下溶解度为4.7g/100g水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料.实验室制备三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]•3H2O的相关反应为: