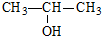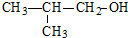题目内容
18. 为实现“绿色化学实验”进课堂,某化学教师将钠与氯气反应的装置作如下改进:将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述中,错误的是( )
为实现“绿色化学实验”进课堂,某化学教师将钠与氯气反应的装置作如下改进:将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述中,错误的是( )| A. | 白烟中的固体小颗粒是氯化钠晶体 | |
| B. | 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免污染空气 | |
| C. | 钠在氯气中着火燃烧产生苍白色火焰 | |
| D. | 发生的反应为2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl. |
分析 钠与氯气反应生成白色固体氯化钠,钠的焰色为黄色,灼烧发出黄色的火焰,氯气有毒,直接排放容易引起空气污染,氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收氯气,据此解答.
解答 解:A.钠与氯气反应生成白色固体氯化钠,故A正确;
B.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收氯气,故B正确;
C.钠的焰色为黄色,灼烧发出黄色的火焰,故C错误;
D.钠与氯气反应生成白色固体氯化钠,方程式:2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl,故D正确;
故选:C.
点评 本题考查了钠,熟悉钠的化学性质是解题关键,注意焰色反应属于元素的性质,题目难度不大.

练习册系列答案
相关题目
2.氧的同位素有16O、17O、18O,氢的同位素有H、D、T,双氧水分子一共有( )
| A. | 6种 | B. | 9种 | C. | 18种 | D. | 36种 |
3.常温下,欲配制密度为1.1g•cm-3、浓度为6mol•L-1的稀盐酸,在体积为100mL、密度为1.19g•cm-3,浓度为12mol•L-1的浓盐酸中需加蒸馏水( )
| A. | 200mL | B. | 100mL | C. | 101mL | D. | 120mL |
13.NaHCO3和NaHSO4的溶液混合后,实际参加反应的离子是( )
| A. | H+和CO32- | B. | HCO3-和H+ | C. | Na+、HCO3-和H+ | D. | HC03-和HSO4- |
3.NA代表阿伏加德罗常数的值,以下说法正确的是( )
| A. | 2NA个HCl分子与44.8L H2和Cl2的混合气体所含的原子数目均为4NA | |
| B. | 32gCu将浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA | |
| C. | 物质的量浓度均为1mol•L-1的NaCl和MgCl2混合溶液中,含有Cl-的数目为3NA | |
| D. | 将NA个Cl2分别通入到足量的水和NaOH溶液中,此时所转移的电子总数均为NA |
10.下列说法正确的是( )
| A. | 原电池的负极、电解池的阳极都发生氧化反应 | |
| B. | 原电池中,溶液中的阴离子移向正极 | |
| C. | 双液原电池中的盐桥是为了联通电路,所以也可以用金属导线代替 | |
| D. | 电解时电解池的阳极一定是阴离子放电 |
7.为了除去CO2中少量的HCl气体,最好将混合气体通过( )
| A. | 浓硫酸 | B. | NaHCO3饱和溶液 | C. | NaOH溶液 | D. | Na2CO3溶液 |
 三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]•3H2O是翠绿色单斜晶体,常温下溶解度为4.7g/100g水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料.实验室制备三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]•3H2O的相关反应为:
三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]•3H2O是翠绿色单斜晶体,常温下溶解度为4.7g/100g水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料.实验室制备三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]•3H2O的相关反应为: