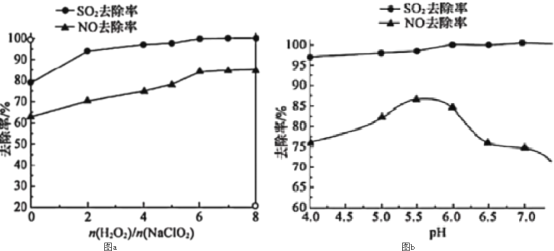
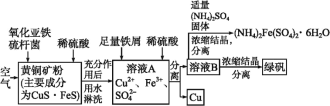
题目内容
【题目】常温下,向纯水中加入NaOH使溶液的pH为11,则由NaOH电离出的OH 离子浓度和水电离出的OH离子浓度之比为 ( )
A.1:1B.108:1C.5×109:1D.1010:1
【答案】B
【解析】
pH=11的NaOH溶液,水电离的c(H+)=10-11mol/L,根据水的离子积常数由NaOH电离产生的c(OH-)=1×1014/1011mol/L=10-3mol/L,而由水电离产生的c(OH-)=c(H+)=10-11mol/L,所以由氢氧化钠电离出的OH-离子浓度与水电离出的OH-离子浓度之比:10-3mol/L:10-11mol/L=108:1
故选B。
【点晴】
本题最大的难点是读懂题目,何胃水电离出的OH-,在NaOH溶液中因氢氧化钠的电离使溶液显碱性,此时溶液里的OH—主要来自氢氧化钠的电离,并且电离出的OH-抑制了水电离,由此可知溶液里的H+来自水的电离,而水电离出的H+与OH-的数目或浓度是相等的,由此展开讨论,结合水的离子积常数进行计算,即根据H2O![]() H++OH-,从影响水的电离平衡移动的角度分析,NaOH抑制水的电离,根据溶液的PH为11,求出水电离出的c(H+)利用水的离子积常数求出氢氧化钠电离出的OH-离子浓度。
H++OH-,从影响水的电离平衡移动的角度分析,NaOH抑制水的电离,根据溶液的PH为11,求出水电离出的c(H+)利用水的离子积常数求出氢氧化钠电离出的OH-离子浓度。

练习册系列答案
相关题目