题目内容
8.用NA表示阿伏加德罗常数.下列说法中,正确的是( )| A. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| B. | 2.0g重水(2H2O)中含有的质子数为1.0 NA | |
| C. | 标准状况下,11.2 LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为NA | |
| D. | 标准状况下,2.24LSO3中含有的O原子的数目为0.3NA |
分析 A、1mol丙烯酸中含2mol双键;
B、质量换算物质的量结合分子式计算质子数;
C、氯气与石灰乳的反应为歧化反应;
D、标况下,三氧化硫为固态.
解答 解:A、丙烯酸中含碳碳双键和碳氧双键,故1mol丙烯酸中含2mol双键,即0.1mol丙烯酸中含有双键的数目为0.2NA,故A错误;
B、2.0 g重水(2H2O)物质的量=$\frac{2g}{20g/mol}$=0.1mol;分子中含有的质子数为1.0 NA,故B正确;
C、氯气与石灰乳的反应为歧化反应,1mol氯气转移1mol电子,故标况下11.2L氯气即0.5mol氯气转移0.5mol电子,即0.5NA个,故C错误;
D、标况下,三氧化硫为固态,不能根据气体摩尔体积来计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列反应中,反应后固体物质质量不变的是( )
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 铝与Fe2O3发生铝热反应 | D. | 将锌粒投入Cu(NO3)2溶液 |
3.常温下,下列表述正确的是( )
| A. | pH=2的CH3COOH溶液的浓度小于pH=2的盐酸的浓度 | |
| B. | 向NaHC03溶液中加入少量NaOH固体,可抑制HCO3-的水解,使c(HCO-)增 大 | |
| C. | Na2C03溶液中:即c(Na+)>C(CO32-)>C(OH-)=C(HCO3-)>C(H+) | |
| D. | 将任意量的CH3COOH溶液与NaOH溶液混合,其混合溶液均存在:C(Na+)+c(H+)=C(CH3COO-)+C(OH-) |
20.2011年3月11日在日本发生的大地震中,福岛核电站发生了核泄漏,其周边区域的空气中漂浮着放射性物质,对环境造成了极大的影响.其中含有碘的同位素${\;}_{53}^{131}$I,${\;}_{53}^{131}$I中的中子数是( )
| A. | 53 | B. | 78 | C. | 131 | D. | 184 |
18.类推的思维方法在化学学习与研究中经常用到,但有时会产生错误的结论.因此,推出的结论最终要经过实践的检验才能决定其是否正确.以下几种类推结论中,正确的是( )
| A. | IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| B. | 第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| C. | Fe3O4可以写成FeO•Fe2O3;Pb3O4也可以写成PbO•Pb2O3 | |
| D. | NaHSO4与NaHSO3溶于水显酸性,则所有酸式盐溶于水显酸性 |
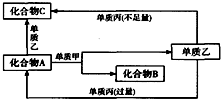 A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙在如图所示的转化关系(转化过程都不需要使用催化剂).
A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙在如图所示的转化关系(转化过程都不需要使用催化剂). $\stackrel{H_{2}O}{→}$2RCOOH
$\stackrel{H_{2}O}{→}$2RCOOH
 .⑤的反应类型是加成反应.G与Br2的CCl4溶液反应,所有可能的产物共有3种.
.⑤的反应类型是加成反应.G与Br2的CCl4溶液反应,所有可能的产物共有3种. .
. .
. .
.

 .
. 硫酸亚铁铵俗名摩尔盐.化学式为x(NH4)2SO4•yFeSO4•zH2O,可用来净水或治疗缺铁性贫血等.某实验小组利用下面的方法来测定其组成.
硫酸亚铁铵俗名摩尔盐.化学式为x(NH4)2SO4•yFeSO4•zH2O,可用来净水或治疗缺铁性贫血等.某实验小组利用下面的方法来测定其组成.