题目内容
【题目】I.研究发现,氮氧化物和硫氧化物是雾霾的主要成分。回答下列问题:
(1)有下列反应:①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
②C(s)+O2(g)=CO2(g) △H2=-393.5 kJ/mol
③2C(s)+O(g)=2CO(g) △H3=-221.0 kJ/mol
已知某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式: _________________。
,请写出此反应的热化学方程式: _________________。
(2)往1L恒容密闭容器中充入一定量的NO2,在三种不同条件下发生反应:2NO2(g)![]() 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)。

①下列说法正确的是___________(填正确选项的序号)
A.实验2容器内压强比实验1的小
B.由实验2和实验3可判断该反应是放热反应
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
E.在0→10mim内实验2的反应速率υ(O2)=0.015mol/(L·min)
②不能判断反应已达到化学平衡状态的是___________(填正确选项的序号)
A.容器内的气体压强不变 B.2υ正(NO2)=υ逆(O2)
C.气体的平均相对分子质量保持不变 D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为 P0kPa,在800℃温度下该反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡后,再向容器中加入NO2和NO各2mol,平衡将___________(填“向正反应方向移动”或“向逆反应方向移动”或“不移动”)。
(3)为了减少雾霾中的SO2,工业尾气中SO2可用饱和Na2SO3溶液吸收,该反应的化学方程式为___________;25℃时,若用1mol/L的Na2SO3溶液吸收SO2,当恰好完全反应时,溶液的pH___________7(填“大于”或“小于”或“等于”),溶液中各离子浓度由大到小的顺序为______________(已知:常温下H2SO3的电离常数Ka1=1.3×10-2,Ka2=6.2×10-8)。
【答案】2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-746.5 kJ/mol DE B 0.25P0 不移动 Na2SO3+SO2+H2O=2NaHSO3 小于 c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
N2(g)+2CO2(g) △H=-746.5 kJ/mol DE B 0.25P0 不移动 Na2SO3+SO2+H2O=2NaHSO3 小于 c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
【解析】
(1)根据平衡常数的定义表达式来书写热化学方程式;
(2)①实验1和实验2在相同的温度下反应,达到平衡时NO2的浓度相同,说明达到相同平衡状态,但实验2达到平衡用时少,反应速率大;实验3在850℃反应,达到平衡时NO2的浓度较800℃小,说明温度升高,平衡向正反应方向移动,则正反应应为吸热反应,反应速率υ=![]() ,以此解答;
,以此解答;
②可逆反应到达平衡时,同种物质表示的正、逆反应速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡,由此分析判断;
③已知容器内的起始压强为 P0kPa,由化学平衡常数的表达式和三段式计算平衡常数;在该温度下达到平衡后,再向容器中加入NO2和NO各2mol,计算此时的浓度商,再和平衡常数比较判断反应进行的方向;
(3)工业尾气中SO2可用饱和Na2SO3溶液吸收,SO2能与饱和Na2SO3溶液反应生成亚硫酸氢钠,根据电离平衡常数计算,判断溶液中亚硫酸氢根离子电离程度和水解程度的大小。
(1)若某反应的平衡常数表达式为:K=![]() ,可知反应为2NO(g)+2CO(g)
,可知反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g),①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
N2(g)+2CO2(g),①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
②C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
③2C(s)+O2(g)=2CO(g) △H3=-221kJ/mol
根据盖斯定律,将②×2-③-①得到2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-746.5 kJ/mol,
N2(g)+2CO2(g) △H=-746.5 kJ/mol,
(2)①A.图表数据可知实验2和实验1温度相同,起始量相同,达到平衡状态c (NO2)相同,但达到平衡状态需要时间,实验2小于实验1,说明是使用了催化剂的作用,实验2容器内压强和实验1的压强相同,A错误;
B.实验3在850℃反应,达到平衡时c (NO2)比800℃小,说明升高温度,化学平衡向正反应方向移动,则正反应应为吸热反应,B错误;
C.升高温度,平衡向正反应方向移动,平衡常数会增大,所以实验3的化学平衡常数比实验1的大,C错误;
D.因实验1和实验2平衡时NO2的浓度相同,但实验2反应速率大,说明实验2使用了催化剂,D正确;
E.2NO2(g)![]() 2NO(g)+O2(g),在0→10mim内实验2的反应速率
2NO(g)+O2(g),在0→10mim内实验2的反应速率![]() ,E正确;
,E正确;
故合理选项是DE;
②对于反应2NO2(g)![]() 2NO(g)+O2(g),
2NO(g)+O2(g),
A.由于该反应是在恒容条件下进行的反应前后气体体积不等的反应,若容器内的气体压强不变,说明反应达到平衡状态,A不符合题意;
B.同一反应速率之比等于化学方程式计量数之比,υ正(NO2)=2υ逆(O2)能说明氧气的正逆反应速率相同,但2υ正(NO2)=υ逆(O2)不能说明反应达到平衡状态,故B符合题意;
C.其他条件不变,若反应未达到平衡状态,气体的物质的量改变,气体的平均相对分子质量就发生变化,因此气体平均相对分子质量保持不变,说明反应达到平衡状态,C不符合题意;
D.NO2和NO的浓度比保持不变说明正逆反应速率相同,反应处于平衡状态,D不符合题意;
故合理选项是B;
③已知容器内的起始压强为 P0kPa,800°C达到平衡状态c(NO2)=0.50mol/L,由于容器的容积为1L,所以n(NO2) =0.50mol,结合三段式法列式计算:
2NO2(g)![]() 2NO(g)+O2(g)
2NO(g)+O2(g)
起始量(mol) 1 0 0
变化量(mol) 0.5 0.5 0.25
平衡量(mol) 0.5 0.5 0.25
平衡状态气体的总物质的量n(总)=0.5mol+0.5mol+0.25mol=1.25mol,则平衡时压强为1.25P0kPa,在800℃温度下该反应的平衡常数Kp=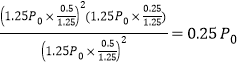 ,在该温度下达到平衡后,平衡常数K=
,在该温度下达到平衡后,平衡常数K=![]() ,再向容器中加入NO2和NO各2mol,浓度商Qc=
,再向容器中加入NO2和NO各2mol,浓度商Qc=![]() ,说明平衡不移动;
,说明平衡不移动;
(3)工业尾气中SO2可用饱和Na2SO3溶液吸收,该反应的化学方程式为:Na2SO3+SO2+H2O=2NaHSO3,25℃时,若用1mol/L的Na2SO3溶液吸收SO2,当恰好完全反应,溶液中生成亚硫酸氢钠,根据题意可知HSO3-的电离平衡常数Ka2= 6.2×10-8,HSO3-在溶液中也存在水解平衡:HSO3-+H2O![]() H2SO3+OH-,水解平衡常数Kh=
H2SO3+OH-,水解平衡常数Kh=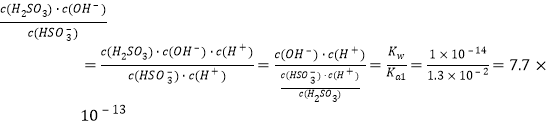 < 6.2×10-8,说明HSO3-离子电离程度大于HSO3-水解程度,溶液显酸性,pH<7,所以溶液中离子浓度大小:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。
< 6.2×10-8,说明HSO3-离子电离程度大于HSO3-水解程度,溶液显酸性,pH<7,所以溶液中离子浓度大小:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。

 阅读快车系列答案
阅读快车系列答案【题目】硫及其化合物是重要的化工原料,某学习小组对某些硫的化合物性质和制备进行如下实验探究:
Ⅰ.探究实验一:将一定量的浓H2SO4与足量Zn置于装置A中充分反应,对反应后的气体X进行气体成分分析(水蒸气除外)。

回答下列问题:
(1)气体X中除水蒸气之外,还可能有的气体是______________________。
(2)B中的试剂可能是__________,酸性KMnO4溶液的作用是_____________。
(3)D、E装置用于证明气体X中的另一种组分,按照D、E装置顺序观察到的实验现象分别是___________、___________。
Ⅱ.探究实验二:制取硫代硫酸钠(Na2S2O3)并探究其性质。
(1)制取Na2S2O3(装置如下图,夹持装置省略)。

①装置B中生成Na2S2O3的同时也生成CO2,反应的离子方程式为___________。
②除搅拌和使用多孔球泡外,再写出一种可以提高B中吸收SO2效率的方法___________。
(2)探究Na2S2O3的性质(反应均在溶液中进行),请填空:
Na2S2O3性质 | 实验操作 | 实验现象 | |
探究1 | Na2S2O3溶液的酸碱性 | ____ | pH=8 |
探究2 | Na2S2O3的还原性 | 向新制的溴水中滴加Na2S2O3溶液 | __________ |


