题目内容
【题目】有以下十种物质:①稀H2SO4 ②纯醋酸(CH3COOH) ③NaOH溶液 ④FeCl3固体 ⑤CaCO3固体 ⑥CO2 ⑦熔融NaHSO4 ⑧Ba(HCO3)2溶液 ⑨乙醇(C2H5OH) ⑩NH3H2O
请回答下列问题
(1)其中能导电的是______________;其中属于非电解质的是_________________;属于弱电解质的是__________________。(填序号)
(2)将题中④物质溶于水配成饱和溶液,滴入沸水中,继续煮沸至出现红褐色可制得Fe(OH)3胶体,写出该过程的化学方程式_______________________________。
(3)按要求写出题中各物质发生反应的离子方程式
①与⑧反应___________________________________________;
②的水溶液与⑤的反应_______________________________________________;
③与⑦的水溶液的反应________________________________。
【答案】①③⑦⑧ ⑥⑨ ②⑩ FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl 2H++SO42-+Ba2++2HCO3-= BaSO4↓+2H2O+2CO2↑ 2CH3COOH+CaCO3=2CH3COO-+Ca2++H2O+CO2↑ H++OH-=H2O
Fe(OH)3(胶体)+3HCl 2H++SO42-+Ba2++2HCO3-= BaSO4↓+2H2O+2CO2↑ 2CH3COOH+CaCO3=2CH3COO-+Ca2++H2O+CO2↑ H++OH-=H2O
【解析】
(1)含有自由移动电子或自由移动的离子的物质能导电;在水溶液和熔融状态下都不能导电的化合物是非电解质;在水溶液中能部分电离的化合物是弱电解质。
(2)FeCl3溶液加热煮沸生成氢氧化铁胶体和氯化氢;
(3)稀H2SO4与碳酸氢钡反应生成硫酸钡沉淀、水、二氧化碳气体;CaCO3固体与醋酸反应生成醋酸钙、水、二氧化碳气体;NaOH溶液与NaHSO4反应生成硫酸钠和水。
(1)①稀H2SO4是混合物,既不是电解质又不是非电解质,稀H2SO4含自由移动的离子,能导电;②纯醋酸(CH3COOH)在水溶液中部分发生电离,属于弱电解质,纯醋酸没有自由移动的离子,不导电;③NaOH溶液是混合物,既不是电解质又不是非电解质,NaOH溶液含自由移动的离子,能导电;④FeCl3固体在水溶液中发生完全电离,属于强电解质,FeCl3固体没有自由移动的离子,不导电;⑤CaCO3固体熔融状态下完全电离,属于强电解质,CaCO3固体没有自由移动的离子,不导电;⑥CO2自身不能电离出自由移动的离子,属于非电解质,不能导电;⑦NaHSO4在水溶液中完全电离,属于强电解质,熔融NaHSO4含有自由移动的离子,能导电;⑧Ba(HCO3)2溶液是混合物,既不是电解质又不是非电解质,Ba(HCO3)2溶液含自由移动的离子,能导电;⑨乙醇不能发生电离,属于非电解质,不含自由移动的离子,不能导电;⑩NH3H2O在水溶液部分电离,属于弱电解质,NH3H2O不含自由移动的离子,不能导电;所以其中能导电的是①③⑦⑧;属于非电解质的是⑥⑨;属于弱电解质的是②⑩。
(2)FeCl3溶液加热煮沸生成氢氧化铁胶体和氯化氢,反应方程式是FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
(3)稀H2SO4与碳酸氢钡反应生成硫酸钡沉淀、水、二氧化碳气体,反应离子方程式是2H++SO42-+Ba2++2HCO3-= BaSO4↓+2H2O+2CO2↑;
CaCO3固体与醋酸反应生成醋酸钙、水、二氧化碳气体,反应离子方程式是2CH3COOH+CaCO3=2CH3COO-+Ca2++H2O+CO2↑;
NaOH溶液与NaHSO4反应生成硫酸钠和水,反应离子方程式是H++OH-=H2O。

 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
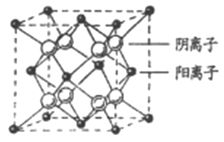
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。