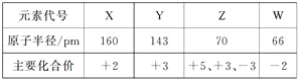
题目内容
【题目】氯气是一种化学性质活泼的气体。
(1)新制备的氯水呈_____色,说明氯水中有_____分子存在。向氯水中滴入几滴AgNO3溶液,现象是________,说明氯水中有_________存在,该反应的化学方程式_______________。
(2)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察的现象是____________。

(3)为防止氯气污染空气,可用______溶液吸收多余的氯气,该反应的化学方程式为________。
【答案】黄绿色 氯气 白色沉淀 HCl AgNO3+HCl=AgCl↓+HNO3 干燥有色布条不退色,湿润有色布条退色 氢氧化钠 Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
(1)氯气微溶于水,Cl2与水反应是可逆反应,根据溶液的成分及各种微粒的性质分析解答;
(2)氯气本身不具有漂白性,可与水反应生成的HClO具有漂白性;
(3)氯气可与氢氧化钠反应,可用于吸收氯气。
(1)氯气微溶于水,溶于水的氯气中有一部分与水发生反应产生HCl、HClO,Cl2+H2O![]() H++Cl﹣+HClO,该反应是可逆反应,由于水中溶解少量氯气而呈黄绿色;氯水中含有HCl电离产生的Cl-,向该溶液中加入AgNO3溶液,产生AgCl白色沉淀,反应的方程式为AgNO3+HCl═AgCl↓+HNO3;
H++Cl﹣+HClO,该反应是可逆反应,由于水中溶解少量氯气而呈黄绿色;氯水中含有HCl电离产生的Cl-,向该溶液中加入AgNO3溶液,产生AgCl白色沉淀,反应的方程式为AgNO3+HCl═AgCl↓+HNO3;
(2)氯气本身不具有漂白性,Cl2与水反应生成具有漂白性的HClO,因此可观察到的现象为干燥有色布条不褪色,湿润有色布条褪色;
(3)氯气可与氢氧化钠反应产生可溶性的物质,因此可用强碱溶液吸收多余的氯气,反应的方程式为Cl2+2NaOH=NaCl+NaClO+H2O。

练习册系列答案
相关题目