题目内容
【题目】硫及其化合物是重要的化工原料,某学习小组对某些硫的化合物性质和制备进行如下实验探究:
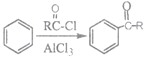
Ⅰ.探究实验一:将一定量的浓H2SO4与足量Zn置于装置A中充分反应,对反应后的气体X进行气体成分分析(水蒸气除外)。

回答下列问题:
(1)气体X中除水蒸气之外,还可能有的气体是______________________。
(2)B中的试剂可能是__________,酸性KMnO4溶液的作用是_____________。
(3)D、E装置用于证明气体X中的另一种组分,按照D、E装置顺序观察到的实验现象分别是___________、___________。
Ⅱ.探究实验二:制取硫代硫酸钠(Na2S2O3)并探究其性质。
(1)制取Na2S2O3(装置如下图,夹持装置省略)。

①装置B中生成Na2S2O3的同时也生成CO2,反应的离子方程式为___________。
②除搅拌和使用多孔球泡外,再写出一种可以提高B中吸收SO2效率的方法___________。
(2)探究Na2S2O3的性质(反应均在溶液中进行),请填空:
Na2S2O3性质 | 实验操作 | 实验现象 | |
探究1 | Na2S2O3溶液的酸碱性 | ____ | pH=8 |
探究2 | Na2S2O3的还原性 | 向新制的溴水中滴加Na2S2O3溶液 | __________ |
【答案】二氧化硫、氢气 品红溶液(或酸性高锰酸钾、溴水) 除去气体中残余的二氧化硫 黑色粉末变红色 白色粉末变蓝色 4SO2+2S2-+CO32-=3S2O32-+CO2 控制二氧化硫的流速、适当增大B中混合液的浓度、适当升高B中溶液温度等 把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在pH试纸的中部,试纸变色后,与标准比色卡比较确定溶液的pH 溴水颜色变浅(或溴水褪色)
【解析】
Ⅰ.在装置A中浓硫酸与Zn反应产生硫酸锌、二氧化硫和水,当反应进行到一定程度,浓硫酸变为稀硫酸,稀硫酸与Zn反应产生硫酸锌和氢气。所以反应产生的气体X中含有水蒸气、SO2、H2,通过品红溶液(或酸性高锰酸钾溶液、溴水等)检验SO2,用酸性KMnO4溶液除去SO2,然后通过浓硫酸干燥,然后通过D使H2发生反应: CuO+H2![]() Cu+H2O,然后通过无水硫酸铜检验H2O的存在。
Cu+H2O,然后通过无水硫酸铜检验H2O的存在。
Ⅱ.浓硫酸与Na2SO3反应产生SO2,SO2与Na2S、Na2CO3发生反应产生Na2S2O3和CO2,SO2、H2S都是大气污染物,要用NaOH溶液进行尾气处理。
Ⅰ.(1)浓硫酸与Zn反应产生硫酸锌、二氧化硫和水,当反应进行到一定程度,浓硫酸变为稀硫酸,Zn与稀硫酸反应产生硫酸锌和氢气。所以气体X除水蒸气外还可能含有SO2、H2;
(2)装置B的作用是检验SO2,SO2具有漂白性、还原性,可以选择品红溶液、酸性高锰酸钾溶液(或溴水)作为检验试剂;检验H2的生成之前,应先排SO2的干扰,故酸性高锰酸钾用来除去气体中残余的SO2;
(3)D、E装置用于证明气体X中的H2,D中H2还原黑色CuO粉末为红色的Cu单质,反应生成的水进入盛有无水硫酸铜的E装置中,会看到白色粉末硫酸铜结合水得到蓝色硫酸铜晶体;
Ⅱ.(1)①装置B中由A制得的SO2与Na2S、Na2CO3反应生成Na2S2O3的同时也生成CO2,根据原子守恒、电子守恒、电荷守恒,可得离子方程式为:4SO2+2S2-+CO32-=3S2O32-+CO2;
②控制SO2的流速、适当增大B中混合液的浓度、适当升高B中溶液温度等都可以提高B中吸收SO2效率;
(2)探究1:由实验现象pH=8可知探究1为测定Na2S2O3溶液的pH值,操作为:把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在pH试纸的中部,待试纸变色后,与标准比色卡比较确定溶液的pH;
探究2:是要测定Na2S2O3溶液的还原性,向该溶液中加入溴水,溴水呈橙色,Na2S2O3溶液无色,若二者发生氧化还原反应,会看到的现象为:溴水颜色变浅(或溴水褪色)。