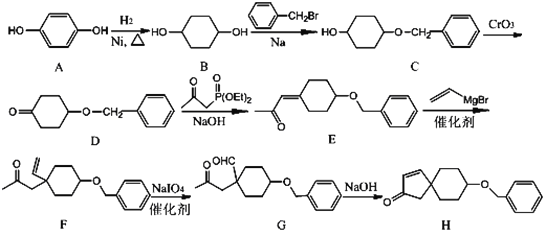
题目内容
【题目】常温下向10mL0.1mol/L氨水中缓缓加蒸馏水稀释到1L后,下列说法不正确的是
A. 电离程度增大,导电能力减弱 B. c(OH- )/c(NH3 ·H2O)增大
C. 溶液中OH- 数目减小 D. Kb (NH3 ·H2O)不变
【答案】C
【解析】A.加水稀释促进电离,所以一水合氨电离程度增大,但溶液中离子浓度减小,则导电性减弱,故A正确;B.加水时电离平衡正向移动,n(OH-)增大,n(NH3H2O)减小,在同一溶液中体积相同,离子的浓度之比等于物质的量之比,则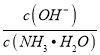 增大,故B正确;C.加水稀释促进一水合氨电离,溶液中OH-数目增多,故C错误;D.温度不变,一水合氨电离平衡常数Kb (NH3 ·H2O)=
增大,故B正确;C.加水稀释促进一水合氨电离,溶液中OH-数目增多,故C错误;D.温度不变,一水合氨电离平衡常数Kb (NH3 ·H2O)= 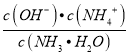 不变,故D正确;故选C。
不变,故D正确;故选C。

【题目】水合碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O],又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90%,碳酸钙10%)碳化法制取:
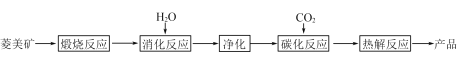
(1)根据下列表格数据,选择消化反应的最佳温度__________;理由是___________________________。
消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为____________。
(3)流程图中__________和__________可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol·L-1时,可以认为完全除去。常温时当调节溶液PH为9.5时,此时Mn2+小于__________mol·L-1,不会沉淀出来。
物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为__________。
A.Ca(ClO)2 B.Cl2 C.H2O2 D.HNO3
③下列方案中,较好的为__________,理由是______________________。
![]()
【题目】H2O2作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
(1)定性分析:图甲可通过观察________________定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_______________________。
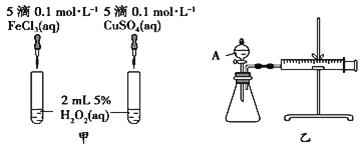
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为_______,检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看__________,实验中需要测量的数据是__________。
(3)加入MnO2粉末于H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
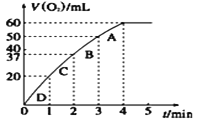
由D到A过程中,随着反应的进行反应速率逐渐_________。(填 “加快”或“减慢”),其变化的原因是_____________。(选填字母编号)
A.改变了反应的活化能 B.改变活化分子百分比
C.改变了反应途径 D.改变单位体积内的分子总数
(4)另一小组同学为了研究浓度对反应速率的影响,设计了如下实验设计方案,请帮助完成(所有空均需填满)。
实验编号 | T/K | 催化剂 | 浓度 |
实验1 | 298 | 3滴FeCl3溶液 | 10ml 2%H2O2 |
实验2 | 298 |
① 在实验2中依次填_______________、________________。
② 可得到的结论是浓度越大,H2O2 分解速率__________。