��Ŀ����
����Ŀ��������A��B����ѧ���������ʣ����������ӿɴӱ���ѡ��.
������ | K+��Na+��NH4+��Fe2+��Ba2+��Cu2+ |
������ | OH����I����NO3����AlO2����HCO3����HSO4�� |
��1����A��ˮ��ҺΪ��ɫ��B��ˮ��Һ�ʼ��ԣ�A��B��ˮ��Һ��Ϻ�ֻ����������ϡ����İ�ɫ��������ʹʪ��ĺ�ɫʯ����ֽ���������壬��:
��A�еĻ�ѧ������Ϊ_________���������Ӽ����������ۼ�������
��A��B��Һ��Ϻ���ȳ����ԣ��÷�Ӧ�����ӷ���__________________________ ��
��2����A��ˮ��ҺΪdz��ɫ��B����ɫ��Ӧ�ʻ�ɫ����A��ˮ��Һ�м���ϡ���������������ټ���B����Һ��ƣ���A��B��ˮ��Һ��Ϻ������Ա仯����
��A�Ļ�ѧʽΪ__________________________ ��
�ھ�����������������Һ��Ƶ�ԭ����������֣���������������
��._______________________����._________________________��
������һ������֤��������Һ��Ƶ�ԭ��_________________________��
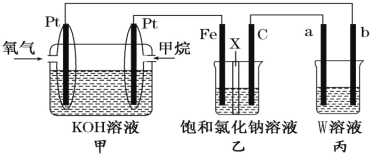
������������������Һ���ԭ����������Ƴ�ԭ��أ���������a����b����b���ĵ缫��ӦʽΪ_��
���𰸡����Ӽ������ۼ� H++SO42��+NH4++Ba2++2OH��![]() BaSO4��+NH3��+2H2O FeI2 ����I����������I2ʹ��Һ�ʻ�ɫ I����Fe2+��������ʹ��Һ�ʻ�ɫ ȡ���������Һ���Թ��У��μӼ���KSCN��Һ�������������������������ɣ� NO3��+4H++3e-�TNO��+2H2O
BaSO4��+NH3��+2H2O FeI2 ����I����������I2ʹ��Һ�ʻ�ɫ I����Fe2+��������ʹ��Һ�ʻ�ɫ ȡ���������Һ���Թ��У��μӼ���KSCN��Һ�������������������������ɣ� NO3��+4H++3e-�TNO��+2H2O
��������
��1�����������ӵ������жϣ�������ϡ����İ�ɫ���������ᱵ������ʹ��ɫʯ����ֽ�����������ǰ�������A��B�к�������������ӡ�笠����ӣ���B��Һ�ʼ��ԣ�����A��������泥�B��������������A�Ļ�ѧʽΪNH4HSO4����ѧ������Ϊ���Ӽ������ۼ���
��A��B��Һ��Ϻ���ȳ����ԣ���˵�������������������ӡ���������ǡ����ȫ��Ӧ�����������ᱵ���������ӷ���ʽΪH++SO42��+NH4++Ba2++2OH��![]() BaSO4��+NH3��+2H2O��
BaSO4��+NH3��+2H2O��
��2����A��ˮ��Һ��dz��ɫ��˵��A�д���Fe2+��B��ˮ��Һ����ɫ������ɫ��ӦΪ��ɫ��˵��B�д���Na+����A��ˮ��Һ�м���ϡ��������������˵��A�������ᷴӦ���ټ���B����Һ��ƣ���Һ�ʻ�ɫ������Fe3+���ɻ���I2���ɡ������B������Һ��Ӧ����ǿ���������ʣ��������������жϣ�����������������ӽ�ϳ�Ϊ�������ǿ�����ԣ�����B��NaNO3��A��FeI2��
�ڵ����ӵĻ�ԭ�Ա��������ӵĻ�ԭ��ǿ�����������ᷢ��������ԭ��Ӧ ʱ�������ȱ�������������Һ��Ƶ�ԭ������������֣���.I-������ΪI2��ʹ��Һ��ƣ����ӷ���ʽΪ6I-+2H++2 NO3-=2NO��+ I2+4H2O��
��.I����Fe2+��������ʹ��Һ�ʻ�ɫ�����ӷ���ʽΪ2I-+4H++ Fe2++NO3-=NO��+ I2+2H2O+Fe3+��
��ȡ���������Һ���Թ��У��μӼ���KSCN��Һ�����������������
������������������Һ���ԭ����������Ƴ�ԭ��أ���������a����b����b��Ϊ��������������������ӵõ��Ӳ���NO���缫��ӦʽΪNO3��+4H++3e-�TNO��+2H2O��

����Ŀ��������ͼװ�òⶨ�к��ȵ�ʵ�鲽�����£�
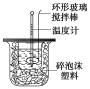
������Ͳ��ȡ50 mL 0.25 mol/L���ᵹ��С�ձ��У����������Һ�¶ȣ�
������һ��Ͳ��ȡ50 mL 0.55 mol/L NaOH��Һ����������¶ȣ�
�۽�NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ�������Һ����¶ȡ�
�ش��������⣺
(1)����NaOH��Һ����ȷ������_________
A���ز������������� B���������������� C��һ��Ѹ�ٵ���
(2)ʹ������NaOH��Һ��Ͼ��ȵ���ȷ������__________
A�����¶ȼ�С�Ľ��� B���ҿ�ӲֽƬ�ò��������� C����������ձ� D���������¶ȼ��ϵĻ��β�������������س鶯
(3)ʵ���������±���
�¶� ʵ������� | ��ʼ�¶�t1�� | ��ֹ�¶�t2/�� | �¶Ȳ�ƽ��ֵ (t2��t1)/�� | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
�ٸ��ݱ������ݼ�������¶Ȳ��ƽ��ֵΪ______����
�ڽ�����Ϊ0.55 mol/L NaOH��Һ��0.25 mol/L������Һ���ܶȶ���1 g/cm3���кͺ�������Һ�ı�����c��4.18 J/(g����)�����к�����H��_______( ȡС�����һλ)��
������ʵ����ֵ������к���Ϊ57.3 kJ/mol��ƫ�����ƫ���ԭ�������____��
a��ʵ��װ�ñ��¡�����Ч���� b�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶� c����ȡNaOH��Һ�����ʱ���Ӷ��� d���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���