题目内容
19.Na2SO4固体中含钠离子.√(判断对错)分析 可从该化合物所含化学键及晶体类型判断是否含有钠离子.
解答 解:Na是第ⅠA族活泼金属,与酸根离子形成离子键,所以Na2SO4属于离子化合物,由阳离子钠离子和阴离子硫酸根离子构成,
故答案为:√.
点评 本题考查了离子化合物的构成,难度不大,注意含有离子键的化合物一定是离子化合物,离子化合物由阴阳离子构成.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.铜、锌、稀硫酸组成的原电池,当导线中通过2mole-时,下列说法正确的是( )
| A. | 锌片溶解65g,铜片上有1molH2生成 | |
| B. | 两极上溶解和析出的物质质量相等 | |
| C. | 锌片每溶解1g,铜片上就析出氢气1g | |
| D. | 锌片溶解1mol,硫酸就消耗1mol |
7.关于下列各实验装置的叙述中,正确的是( )
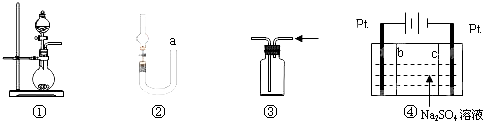

| A. | 图①可用于制取少量NH3或用MnO2和浓盐酸制取Cl2 | |
| B. | 可用从a处加水的方法检验图②装置的气密性 | |
| C. | 实验室可用图③的方法收集Cl2或NH3 | |
| D. | 利用图④装置制硫酸和氢氧化钠,其中c为阴离子交换膜、b为阳离子交换膜 |
11.合成二甲醚的三步反应如下:
2H2(g)+CO(g)?CH3OH(g)△H1
2CH3OH (g)?CH3OCH3 (g)+H2O(g)△H2
CO(g)+H2O(g)?CO2(g)+H2(g)△H3
则 3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g) 的△H是( )
2H2(g)+CO(g)?CH3OH(g)△H1
2CH3OH (g)?CH3OCH3 (g)+H2O(g)△H2
CO(g)+H2O(g)?CO2(g)+H2(g)△H3
则 3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g) 的△H是( )
| A. | △H=2△H1+△H2+△H3 | B. | △H=△H1+△H2+△H3 | ||
| C. | △H=△H1+2△H2+2△H3 | D. | △H=2△H1+△H2-△H3 |
8.${\;}_{\;}^{16}$O、${\;}_{\;}^{18}$O是氧元素的两种原子,下列说法正确的是( )
| A. | ${\;}_{\;}^{16}$O和${\;}_{\;}^{18}$O的物理性质相同、化学性质不相同 | |
| B. | 通过化学反应可实现${\;}_{\;}^{16}$O与${\;}_{\;}^{18}$O之间相互转化 | |
| C. | ${\;}_{\;}^{16}$O和${\;}_{\;}^{18}$O的原子核外电子排布的方式不相同 | |
| D. | ${\;}_{\;}^{16}$O和${\;}_{\;}^{18}$O能形成三种化学性质相同的氧分子 |

 .
. ,则R有4种.
,则R有4种.
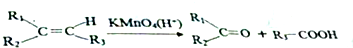
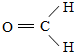 .
.