题目内容
3.下列叙述正确的是( )| A. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 用惰性电极电解饱和KBr溶液,若有1 mol电子转移,则生成1 molKOH | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
分析 A.电解池的阴极发生还原反应;
B.用惰性电极电解Na2SO4溶液,阴阳两极分别生成氢气和氧气;
C.用惰性电极电解饱和KBr溶液,生成氢气、溴和KOH;
D.铁比锡活泼,镀层破坏时易被氧化.
解答 解:A.原电池的负极发生氧化反应,电解池的阴极发生还原反应,故A错误;
B.惰性电极电解Na2SO4溶液,实质是电解水,阳极是氢氧根离子失电子生成氧气,阴极是氢离子得到电子生成氢气,阴阳两极产物的物质的量之比为2:1,故B错误;
C.惰性电极电解饱和KBr溶液,阳极氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气,依据电极反应电子守恒计算2H++2e-=H2↑,若有1mol电子转移,氢离子减小1mol,溶液中氢氧根离子增加1mol,则生成1mol KOH,故C正确;
D.镀锌铁破损后形成原电池反应,锌作负极,铁做正极被保护,镀层破损后,镀锌铁板依然耐腐蚀,故D错误.
故选C.
点评 本题考查了原电池、电解池原理的分析应用,为高频考点,侧重于学生的分析能力的考查,住把握电解名称、电极反应和电极产物的分析判断,难度不大.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
13.向50mL 18mol•L-1H2SO4溶液中加入足量的铜片并加热.充分反应后,被还原的H2SO4的物质的量( )
| A. | 小于0.45 mol | B. | 等于0.45 mol | ||
| C. | 在0.45 mol和0.90 mol之间 | D. | 大于0.90 mol |
14.下列实验装置或操作能达到实验目的是( )
| A. |  定量测定反应速率 | B. | 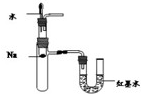 验证Na和水反应的热效应 | ||
| C. | 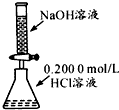 酸碱中和滴定 | D. | 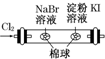 证明氧化性Cl2>Br2>I2 |
11.50℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A. | pH=4的醋酸中:c(H+)=4.0molL-1 | |
| B. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) | |
| C. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2molL-1 | |
| D. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
8.日常所用干电池的电极分别为碳棒(上面有铜帽)和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2),电极反应式可简化为:Zn-2e-=Zn2+,2NH4++2e-=2NH3↑+H2↑(NH3与Zn2+能生成一种稳定的物质).根据上述判断,下列结论正确的是( )
| A. | Zn为正极,碳为负极 | |
| B. | Zn为负极,碳极发生氧化反应 | |
| C. | 工作时,电子由碳极经过电路流向Zn极 | |
| D. | 长时间连续使用时,内装糊状物可能流出腐蚀用电器 |
15.香烟烟雾中含有CO、CO2、SO2、H2O等气体,用A.无水硫酸铜、B.澄清石灰水、C.红热氧化铜、D.生石灰、E.酸性品红溶液,F.酸性高锰酸钾溶液等将其一一检出,检出的正确顺序是( )
| A. | 混合气体→A→E→B→A→D→C | B. | 混合气体→C→D→E→E→A | ||
| C. | 混合气体→A→E→F→E→B→D→C | D. | 混合气体→B→E→A→D→C |
12.下列物质转化需要加入还原剂才能实现的是( )
| A. | SO32-→SO2 | B. | HCl→Cl2 | C. | Na→Na+ | D. | CO2→CO |
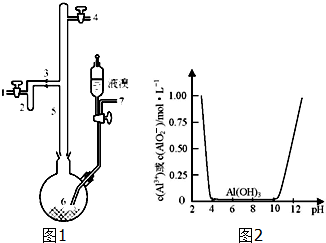 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.