题目内容
11.50℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )| A. | pH=4的醋酸中:c(H+)=4.0molL-1 | |
| B. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) | |
| C. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2molL-1 | |
| D. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
分析 A.根据c(H+)=10-pH进行计算;
B.碳酸氢钠是强碱弱酸酸式盐,谁弱谁水解,谁强谁显性,所以碳酸氢根离子易水解;
C.任何溶液中都遵循电荷守恒;
D.根据水的离子积常数计算氢氧根离子浓度.
解答 解:A.pH=4的醋酸中,c(H+)=10-pH=10-4mol/L,故A错误;
B.碳酸氢钠是强碱弱酸酸式盐,碳酸氢根离子易水解,而钠离子不水解,所以溶液中满足:c(Na+)>c(HCO3-),故B错误;
C.水的离子积常数与温度有关,温度升高,水的电离程度增大,水的离子积常数增大,50℃下,水的离子积常数大于10-14,所以pH=12的纯碱溶液中:c(OH-)>1.0×10-2mol•L-1,故C错误;
D.氯化钠溶液呈电中性,阴阳离子所带电荷相等,所以c(Na+)+c(H+)=c(Cl-)+c(OH-),故D正确;
故选D.
点评 本题考查离子浓度的大小比较,题目难度中等,注意根据盐的水解原理、电荷守恒、物料守恒来分析离子浓度大小,试题侧重考查学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
1.某一周期的第ⅡA族元素的原子序数为Z,那么同一周期的第ⅢA族元素的原子序数( )
| A. | 可能是Z+1或Z+11或Z+25 | B. | 只有Z+1 | ||
| C. | 可能是Z+1或Z+11 | D. | 可能是Z+2或Z+8或Z+18 |
2.下列化学用语能正确表示相应意义的是( )
| A. | 乙烯的结构简式CH2CH2 | B. | 丁烷的结构简式CH3(CH2)2CH3 | ||
| C. | 四氯化碳的电子式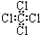 | D. | 苯的分子式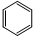 |
19.下列物质:①氯气 ②二氧化硫 ③活性炭 ④漂白粉,都能使品红溶液褪色,但褪色过程不发生氧化还原反应的是( )
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②③④ |
3.下列叙述正确的是( )
| A. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 用惰性电极电解饱和KBr溶液,若有1 mol电子转移,则生成1 molKOH | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
20.下列说法不正确的是( )
| A. | 可通过酸性高锰酸钾溶液来区别乙烷和乙炔 | |
| B. | 乙烯是石油裂解后的产物 | |
| C. | 石油的分馏、煤的干馏是物理变化,石油的裂解和裂化是化学变化 | |
| D. | 棉花、蛋白质、淀粉都是高分子化合物,都能发生水解反应 |
1.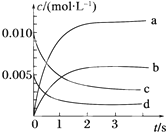 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)上述反应是(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为65%.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s).
(2)如图所示,表示NO2变化曲线的是b.
(3)能说明该反应已达到平衡状态的是bc(填序号).
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图所示,表示NO2变化曲线的是b.
(3)能说明该反应已达到平衡状态的是bc(填序号).
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
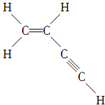 则分子中有7个 σ 键,3个 π 键.
则分子中有7个 σ 键,3个 π 键. +9O2$\stackrel{点燃}{→}$6CO2+6H2O.
+9O2$\stackrel{点燃}{→}$6CO2+6H2O.