题目内容
11. 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.I.实验室制取无色的无水AlBr3(熔点:97.5℃,沸点:263.3℃~265℃,在空气中AlBr3遇水蒸气易发生水解)可用如图1所示装置,主要实验步骤如下:
步骤l.将铝箔剪碎,用CCl4浸泡片刻,干燥,然后投入
到烧瓶6中.
步骤2.从导管口7导入氮气,同时打开导管口l和4排出空气,一段时间后关闭导管口7和1;导管口4接装有P2O5的干燥管.
步骤3.从滴液漏斗滴入一定量的液溴于烧瓶6中,并保证
烧瓶6中铝过剩.
步骤4.加热烧瓶6,回流一定时间.
步骤5.将氮气的流动方向改为从导管口4到导管口l.将装有P2O5的干燥管与导管口1连接,将烧瓶6加热至270℃左右,使AlBr3蒸馏进入收集器2.
步骤6.蒸馏完毕时,在继续通入氮气的情况下,将收集器2从3处拆下,并立即封闭3处.
(1)步骤l中,铝箔用CCl4浸泡的目的是除去铝箔表面的油脂等有机物.
(2)步骤2操作中,通氮气的目的是排去装置中含水蒸气的空气.
(3)步骤3中,该实验要保证烧瓶中铝箔过剩,其目的是保证液溴完全反应,防止溴过量混入AlBr3中.
(4)步骤4依据何种现象判断可以停止回流操作5的管中回流液呈无色(或烧瓶6中物质呈无色).
(5)步骤5需打开导管口l和4,并从4通入N2的目的是将AlBr3蒸气导入装置2中并冷凝.
Ⅱ.某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图2所示,实验中可选用的试剂:处理过的铝箔;2.0mol•L-1NaOH溶液:2.0mol•L-1硫酸
(6)由铝箔制备硫酸铝晶体的实验步骤依次为:
①称取一定质量的铝箔于烧杯中,分次加入2.0mol•L-1NaOH溶液,加热至不再产生气泡为止.
②过滤,③滤液用2.0mol•L-1硫酸在不断搅拌下调到pH4~10左右;
④过滤、洗涤沉淀;⑤向沉淀中不断加入2.0mol•L-1硫酸,至恰好溶解;
⑥蒸发浓缩;⑦冷却结晶;⑧过滤、洗涤、干燥.
分析 I.(1)铝箔表面会有油污,根据相似相溶原理知,有机溶质易溶于有机溶剂;
(2)溴化铝易水解生成氢氧化铝和HBr;
(3)如果溴过量,溴易混入溴化铝中;
(4)当5的管中回流液呈无色或烧瓶6中物质呈无色,说明可以停止回流;
(5)将溴化铝蒸汽导入装置2中并冷凝得到溴化铝;
II.(6)③根据图片知,pH在4-10时生成氢氧化铝沉淀;
⑥从溶液中获得晶体采用加热浓缩、冷却结晶的方法.
解答 解:I.(1)铝箔表面易沾有油脂,油脂属于有机物,根据相似相溶原理知,有机溶质易溶于有机溶剂,所以用四氯化碳除去铝箔表面的油脂,
故答案为:除去铝箔表面的油脂等有机物;
(2)溴化铝易水解生成氢氧化铝和HBr,为防止溴化物在空气中的水蒸气中水解,用氮气将装置中空气(含水蒸气)排出,
故答案为:排出装置中含有水蒸气的空气;
(3)如果溴过量,溴易混入溴化铝中,所以为保证液溴完全反应,该实验要保证烧瓶中铝箔过剩,
故答案为:保证溴完全反应,防止溴过量混入溴化铝中;
(4)当5的管中回流液呈无色或烧瓶6中物质呈无色,说明溴恰好完全反应,则可以停止回流,
故答案为:5的管中回流液呈无色(或烧瓶6中物质呈无色);
(5)步骤5需打开导管口l和4,利用压强差将溴化铝蒸汽导入装置2并冷凝得到溴化铝,
故答案为:将AlBr3蒸气导入装置2中并冷凝;
II.(6)③根据图片知,pH在4-10时生成氢氧化铝沉淀,所以该步骤是向溶液中滴加稀硫酸并调节溶液pH为4-10,从而得到氢氧化铝沉淀,
故答案为:滤液用2.0mol/L硫酸在不断搅拌下调到pH4-10左右;
⑥从溶液中获得晶体采用加热浓缩、冷却结晶的方法,所以该操作为蒸发浓缩,故答案为:蒸发浓缩.
点评 本题考查AlBr3、硫酸铝制备实验方案设计,侧重考查学生制备、操作等基本能力,明确实验原理是解本题关键,题目难度中等.

| A. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 用惰性电极电解饱和KBr溶液,若有1 mol电子转移,则生成1 molKOH | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
| 实验序号 | HCl溶液浓度(mol/L) | BOH溶液溶液(mol/L) | 混合后溶液pH |
| 甲 | 0.10 | 0.10 | 4.7 |
| 乙 | 0.10 | 0.30 | 7 |
| 丙 | 0.10 | 0.50 | 8.2 |
(1)试写出BOH在溶液中的电离方程式:BOH?B++OH-
(2)甲组混合溶液中离子浓度由大到小的顺序为:c(Cl-)>c(B+)>c(H+)>c(OH-)
(3)乙组混合溶液中B-离子浓度c(B-)=0.05 mol/L
(4)丙组混合溶液中c(BOH)、c(B-)、c(Cl-)浓度大小关系为c(BOH)>c(B+)>c(Cl-)
(5)根据乙组实验,列式并计算BOH在常温下的电离平衡常数Kb=5×10-8.
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图所示,表示NO2变化曲线的是b.
(3)能说明该反应已达到平衡状态的是bc(填序号).
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.

温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图2-图5所示)
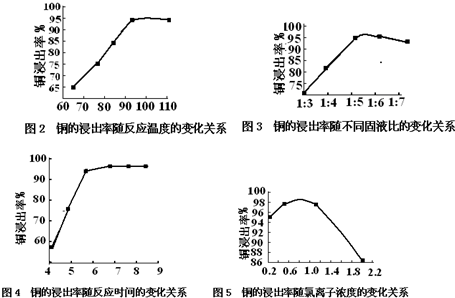
(1)根据实验以及工业生产的实际要求,从图2-图5中得出的最佳工艺条件为(从下表中选出序号)A.
| 反应温度/℃ | 固液比 | c(Cl-)/mol•L-1 | 反应时间/h | |
| A | 95 | 1:5.5 | 0.8 | 6 |
| B | 100 | 1:5.5 | 0.7 | 7 |
| C | 110 | 1:6 | 0.9 | 8 |
(3)副产品FeSO4•7H2O样品的纯度可用滴定法进行测定,实验步骤如下:
步骤1:称取5.800g绿矾产品,经溶解、定容等步骤准确配制250mL溶液.
步骤2:从上述容量瓶中量取25.00mL待测溶液于锥形瓶中,
步骤3:用硫酸酸化的0.0100mol/L KMnO4溶液滴定至终点,记录消耗KMnO4溶液体积
步骤4:重复步骤2、步骤3一至两次.
①步骤1中用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管和250mL容量瓶,步骤2量取溶液所用仪器是酸式滴定管.
②写出步骤3反应的离子方程式5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O:
③数据处理:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00mL | 0.02 | 40.01 |
| 2 | 25.00mL | 0.70 | 40.71 |
| 3 | 25.00mL | 0.20 | 39.20 |
④不考虑操作误差,用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(填偏低、偏高或无影响).

 A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应.
A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应. ,反应③的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,反应③的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.