题目内容
12.下列物质转化需要加入还原剂才能实现的是( )| A. | SO32-→SO2 | B. | HCl→Cl2 | C. | Na→Na+ | D. | CO2→CO |
分析 需要加入还原剂才能实现,说明题中给予物质作氧化剂,在反应中得电子化合价降低,据此分析解答.
解答 解:A.元素化合价没有发生变化,可经复分解反应生成,故A错误;
B.Cl元素化合价升高,被氧化,应加入氧化剂,故B错误;
C.Na元素化合价升高,被氧化,应加入氧化剂可实现,故C错误;
D.C元素化合价降低,被还原,应加入还原剂,故D正确.
故选D.
点评 本题考查了氧化还原反应,根据元素化合价变化再结合基本概念来分析解答,知道物质的性质及元素化合价即可解答,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
2.下列化学用语能正确表示相应意义的是( )
| A. | 乙烯的结构简式CH2CH2 | B. | 丁烷的结构简式CH3(CH2)2CH3 | ||
| C. | 四氯化碳的电子式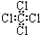 | D. | 苯的分子式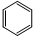 |
3.下列叙述正确的是( )
| A. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 用惰性电极电解饱和KBr溶液,若有1 mol电子转移,则生成1 molKOH | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
20.下列说法不正确的是( )
| A. | 可通过酸性高锰酸钾溶液来区别乙烷和乙炔 | |
| B. | 乙烯是石油裂解后的产物 | |
| C. | 石油的分馏、煤的干馏是物理变化,石油的裂解和裂化是化学变化 | |
| D. | 棉花、蛋白质、淀粉都是高分子化合物,都能发生水解反应 |
17.下列变化或措施符合勒夏特列原理解释的是( )
| A. | 红棕色的NO2加压后颜色先变深再变浅 | |
| B. | H2、I2、HI混合气体加压后颜色变深 | |
| C. | 合成氨时高温、高压对合成氨有利 | |
| D. | 醋酸溶液稀释时,溶液pH增大 |
4.常温下,将盐酸和一元碱BOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
根据实验结果,回答下列问题:
(1)试写出BOH在溶液中的电离方程式:BOH?B++OH-
(2)甲组混合溶液中离子浓度由大到小的顺序为:c(Cl-)>c(B+)>c(H+)>c(OH-)
(3)乙组混合溶液中B-离子浓度c(B-)=0.05 mol/L
(4)丙组混合溶液中c(BOH)、c(B-)、c(Cl-)浓度大小关系为c(BOH)>c(B+)>c(Cl-)
(5)根据乙组实验,列式并计算BOH在常温下的电离平衡常数Kb=5×10-8.
| 实验序号 | HCl溶液浓度(mol/L) | BOH溶液溶液(mol/L) | 混合后溶液pH |
| 甲 | 0.10 | 0.10 | 4.7 |
| 乙 | 0.10 | 0.30 | 7 |
| 丙 | 0.10 | 0.50 | 8.2 |
(1)试写出BOH在溶液中的电离方程式:BOH?B++OH-
(2)甲组混合溶液中离子浓度由大到小的顺序为:c(Cl-)>c(B+)>c(H+)>c(OH-)
(3)乙组混合溶液中B-离子浓度c(B-)=0.05 mol/L
(4)丙组混合溶液中c(BOH)、c(B-)、c(Cl-)浓度大小关系为c(BOH)>c(B+)>c(Cl-)
(5)根据乙组实验,列式并计算BOH在常温下的电离平衡常数Kb=5×10-8.
1.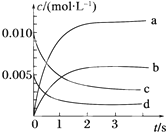 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)上述反应是(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为65%.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s).
(2)如图所示,表示NO2变化曲线的是b.
(3)能说明该反应已达到平衡状态的是bc(填序号).
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图所示,表示NO2变化曲线的是b.
(3)能说明该反应已达到平衡状态的是bc(填序号).
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
 .若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2-二甲基丁烷,则烃A的名称是3,3-二甲基-1-丁烯,结构简式是(CH3)3C-CH=CH2.比烃A少两个碳原子且能使溴水褪色的A的同系物有3种同分异构体.
.若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2-二甲基丁烷,则烃A的名称是3,3-二甲基-1-丁烯,结构简式是(CH3)3C-CH=CH2.比烃A少两个碳原子且能使溴水褪色的A的同系物有3种同分异构体.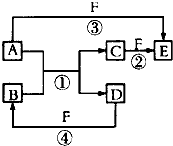 A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应.
A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应. ,反应③的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,反应③的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.