题目内容
8.已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占有三种能量不同的原子轨道,且每种轨道中的电子总数相 同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外 电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.请回答下列问题(答题时,A、B、C、D、E用所对应元素符号表示):
(1)A2D2分子的电子式为
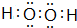 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.(2)A、B、C、D四种元素中电负性大小顺序的是O>N>C>H.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a.M是极性分子,N是非极性分子 b.M和BD2分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和1个π键 d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
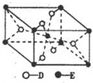
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
②已知:
Q(s)+2Cl2(g)═ECl4(l)+D2(g)△H=+140kJ•mol-1
2B(s)+D2(g)═2BD(g)△H=-221kJ•mol-1
写出物质Q和焦炭、氯气反应生成液态ECl4(l)和BD气体的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1,K2的大小,K1>K2(填写“>”、“=”或“<”).
②在400℃,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 v(C2)正>v(C2)逆(填写“>”、“=”或“<”)
分析 A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素,则A为氢元素;B的基态原子中电子占有三种能量不同的原子轨道,且每种轨道中的电子总数相同,核外电子排布式为1s22s22p2,则B为碳元素;D原子的核外成对电子数是未成对电子数的3倍,原子只能有2个电子层,最外层电子数为6,故D为O元素;C原子序数介于碳、氧之间,故D为N元素;E有“生物金属”之称,E4+和氩原子的核外 电子排布相同,E原子核外电子数为18+4=22,故E为Ti;A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,则M为HCHO,A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,则N为C6H6,据此解答.
解答 解:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素,则A为氢元素;B的基态原子中电子占有三种能量不同的原子轨道,且每种轨道中的电子总数相同,核外电子排布式为1s22s22p2,则B为碳元素;D原子的核外成对电子数是未成对电子数的3倍,原子只能有2个电子层,最外层电子数为6,故D为O元素;C原子序数介于碳、氧之间,故D为N元素;E有“生物金属”之称,E4+和氩原子的核外 电子排布相同,E原子核外电子数为18+4=22,故E为Ti;A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,则M为HCHO,A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,则N为C6H6.
(1)H2O2分子的电子式为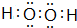 ,E为Ti元素,核外电子数为22,其基态原子的外围电子排布式为3d24s2,故答案为:
,E为Ti元素,核外电子数为22,其基态原子的外围电子排布式为3d24s2,故答案为: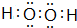 ;3d24s2;
;3d24s2;
(2)同周期自左而右电负性增大,非金属性越强电负性越大,故电负性:O>N>C>H,故答案为:O>N>C>H;
(3)碳与浓硝酸反应生成二氧化氮、二氧化碳与水,反应方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(4)a.HCHO为平面三角形,分子中正负电荷重心不重合,属于极性分子,苯是平面正六边形对称结构,为非极性分子,故a正确;
b.HCHO分子中碳原子成2个C-H键、1个C=O键,杂化轨道数为3,碳原子采取sp2杂化,二氧化碳分子中碳原子成2个C=O键,碳原子杂化轨道数为2,碳原子采用sp杂化,故b错误;
c.苯分子中含有12个σ键和1个大π键,故c错误;
d.CO2晶体属于分子晶体,二氧化硅属于原子晶体,CO2晶体的熔点、沸点都比二氧化硅晶体的低,故d正确;
故答案为:ad;
(5)由晶胞结构可知,晶胞中Ti元素数目为1+8×$\frac{1}{8}$=2,O原子数目为2+4×$\frac{1}{2}$=4,故该氧化物Q的化学式为TiO2,
已知:①.TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ•mol-1
②.2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
根据盖斯定律,①+②可得:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol,
故答案为:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol;
(6)①正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,即K1>K2,故答案为:>;
②在400℃,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,产生浓度商Qc=$\frac{(\frac{3}{0.5})^{2}}{\frac{1}{0.5}×(\frac{2}{0.5})^{3}}$=0.28,小于平衡常数0.5,故反应向正反应进行,则该反应的 v(C2)正>v(C2)逆,故答案为:>.
点评 本题是对物质结构的考查,涉及电负性、核外电子排布、杂化方式、分子结构与性质、晶胞计算、热化学方程式书写、平衡常数影响因素及应用等,是对学生综合能力的考查,推断元素是解题的关键.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案| A. | 原子最外层只有两个电子的元素都在第ⅡA族 | |
| B. | 人们通常在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料 | |
| C. | 共价化合物中可能含有离子键 | |
| D. | 水溶液能导电的化合物都是离子化合物 |
| A. | 在元素周期表左下方区域的金属元素中寻找半导体材料 | |
| B. | 利用元素周期表中氟、氯、硫、磷附近的元素研制新型农药 | |
| C. | 在过渡金属中寻找催化剂和耐高温、耐腐蚀的合金材料 | |
| D. | 在周期表一定区域内寻找元素、发现物质的新用途是一种相当有效的方法 |
| A. | pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-) | |
| B. | pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-) | |
| C. | V[C6H5OH(aq)]=20ml时,c(C6H5O-)+c(C6H5OH)=2c(K+) | |
| D. | V[C6H5OH(aq)]=10ml时,c(K+)=c(C6H5O-)>c(OH-)=c(H+) |
| A. | 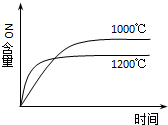 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-a kJ•mol-1 | |
| B. | 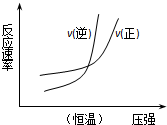 N2(g)+3H2(g)?2NH3(g)△H=-b kJ•mol-1 N2(g)+3H2(g)?2NH3(g)△H=-b kJ•mol-1 | |
| C. | 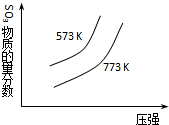 2SO3(g)?2SO2(g)+O2(g)△H=+c kJ•mol-1 2SO3(g)?2SO2(g)+O2(g)△H=+c kJ•mol-1 | |
| D. | 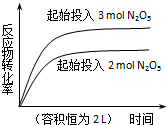 2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 2N2O5(g)?4NO2(g)+O2(g)△H=+d kJ•mol-1 |
| A. | Na、Al、Mg的还原性依次增强 | B. | Na、K、Rb的金属性依次减弱 | ||
| C. | Al、Si、P的原子半径依次增大 | D. | B、C、N的最高正化合价依次升高 |
| A. | CH3C18OOH与C2H518OH | B. | CH3C18O18OH与C2H518OH | ||
| C. | CH3CO18OH与C2H518OH | D. | CH3CO18OH 与C2H5OH |