题目内容
【题目】常温下,用0.10 moI/LNaOH溶液滴定0.10 mol/LHA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列叙述错误的是
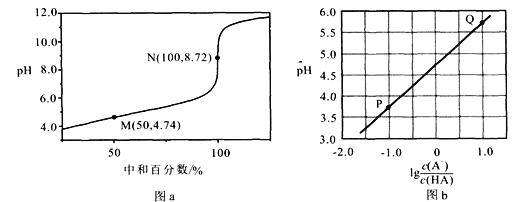
A. Ka(HA)的数量级为10-5
B. N点,![]()
C. P—Q过程中,水的电离程度逐渐增大
D. 当滴定至溶液呈中性时,c(A-)>c(HA)
【答案】B
【解析】
A. 根据图a可知,中和百分数为50%时溶液的pH=4.74,此时溶液的组成为等物质的量浓度的NaA和HA,由于A-的水解和HA的电离都是微弱的,c(A-)≈c(HA),Ka(HA)=![]() ,故Ka(HA)的数量级为10-5,选项A正确;
,故Ka(HA)的数量级为10-5,选项A正确;
B. N点,根据电荷守恒有![]() ,即
,即![]() ,选项B错误;
,选项B错误;
C. P—Q过程中,随着氢氧化钠溶液的滴入,酸不断消耗,溶液的酸性逐渐减弱,水的电离程度逐渐增大,选项C正确;
D. 根据图b可知当lg![]() (即
(即![]() )时,溶液呈酸性,当滴定至溶液呈中性时,溶液中c(A-)>c(HA),选项D正确。
)时,溶液呈酸性,当滴定至溶液呈中性时,溶液中c(A-)>c(HA),选项D正确。
答案选B。

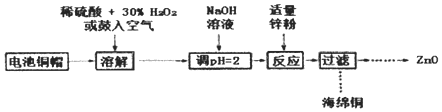
【题目】PbCO3可用于油漆、陶瓷和玻璃等工业。由方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2)制备PbCO3的流程如下:
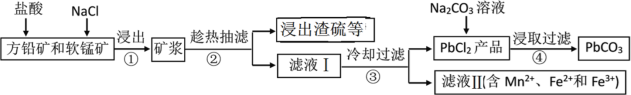
已知:PbCl2难溶于冷水和乙醇,易溶于热水;各物质的溶度积见表。试回答下列问题:
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | PbCl2 | PbS | PbCO3 |
Ksp | 2×10-13 | 8.0×10-16 | 1×10-38 | 1.6×10-5 | 8.0×10-28 | 7.4×10-14 |
(1)PbCO3的名称是________。
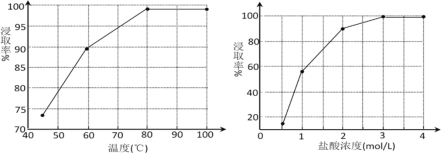
(2)步骤①中MnO2的作用是________,根据下图分析过程①的最佳反应条件是_________。
(3)步骤②趁热抽滤的原因是___________________。
(4)步骤③洗涤用的试剂是____________。
(5)将滤液Ⅱ先酸化,然后加入MnO2,反应的离子方程式为________;若反应后![]() ,进一步调节溶液的pH可分离出Fe3+和Mn2+,则调节溶液pH的范围为_________
,进一步调节溶液的pH可分离出Fe3+和Mn2+,则调节溶液pH的范围为_________![]() 时表示Fe3+已沉淀完全]。
时表示Fe3+已沉淀完全]。
(6)步骤④反应的离子方程式为______________。