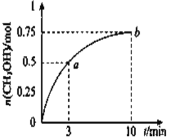
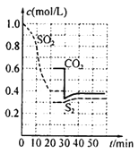
题目内容
【题目】实验室中用下列装置测定SO2催化氧化为SO3的转化率(部分夹持装置已省略,已知SO3的熔点为16.8℃,假设气体进入装置时均被完全吸收,且忽略空气中CO2的影响),下列说法不正确的是( )
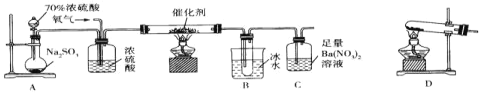
A.A装置烧瓶中发生的反应可以表示为SO32-+2H+=SO2↑+H2O
B.用D装置制备氧气,试管中的药品可以是KClO3
C.当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气
D.C中产生的白色沉淀是BaSO4
【答案】B
【解析】
A.70%的浓硫酸和亚硫酸钠反应产生二氧化硫,A装置烧瓶中发生的反应可以表示为:SO32-+2H+=SO2↑+H2O,故A正确;
B.D装置加热固体制备氧气,可以用KMnO4,加热分解KClO3,需要MnO2作催化剂,故B错误;
C.对于定量测定实验,需要排除空气、水蒸气的干扰,还要将产物三氧化硫以及未反应的二氧化硫全部驱赶到后续装置中以进行准确测量或称量,故停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,故C正确;
D.装置C中发生反应为:3SO2+3Ba2++2NO3-+2H2O=4H++2NO↑+3BaSO4↓,白色沉淀为BaSO4,故D正确;
故答案选B。

练习册系列答案
相关题目