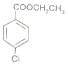
题目内容
【题目】近年研究表明离子液体型催化剂GIL可对某些特定加成反应有很好的催化作用,有机化合物H的合成路线如下: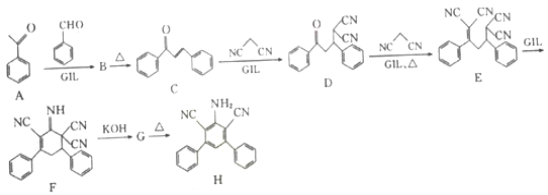
(1) C中含有的官能团名称为______________。
(2) C—D的反应类型为______________。
(3)已知:G和H的分子式相同,F→G和B→C反应类型均为消去反应,那么G的结构简式为______________。
(4)写出满足下列条件的B的一种同分异构体X的结构简式: ______________。
①1 mol X完全水解消耗2 mol NaOH;
②水解酸化后两种产物核磁共振氢谱均有4个峰,峰高比为3:2:2:1。
X在酸性条件下发生水解反应的产物名称为_________。
(5)以乙醇为原料利用GIL合成聚酯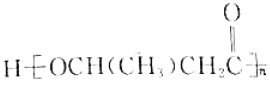 写出合成路线流程图(无机试剂可任选,合成路线流程图示例见本题题干)______________。
写出合成路线流程图(无机试剂可任选,合成路线流程图示例见本题题干)______________。
【答案】羰基和碳碳双键 加成反应 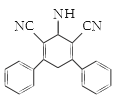
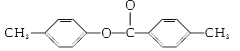 对甲基苯酚和对甲基苯甲酸
对甲基苯酚和对甲基苯甲酸 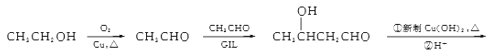
![]()
【解析】
(1)根据C的结构简式,C中含有的官能团是羰基和碳碳双键;
(2)对比C和D的结构简式,C→D的反应类型为加成反应;
(3)F→G发生消去反应,对比F和G的结构简式,则G的结构简式为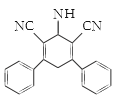 ;
;
(4)B→C发生消去反应,以及对比A和C结构简式,推出B的结构简式为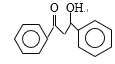 ,1mol X完全水解消耗2mol NaOH,根据B的结构简式,X中应含有“
,1mol X完全水解消耗2mol NaOH,根据B的结构简式,X中应含有“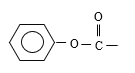 ”,水解酸化后得到两种产物,它们的核磁共振氢谱均有4个峰,说明含有四种不同环境的氢原子,峰高比为3:2:2:1,这是不同氢原子的个数比,即X的结构简式为
”,水解酸化后得到两种产物,它们的核磁共振氢谱均有4个峰,说明含有四种不同环境的氢原子,峰高比为3:2:2:1,这是不同氢原子的个数比,即X的结构简式为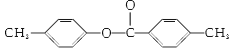 ,水解后得到对甲基苯酚和对甲基苯甲酸;
,水解后得到对甲基苯酚和对甲基苯甲酸;
(5)该聚酯的单体为HOCH(CH3)CH2COOH,根据流程,A生成B碳原子数增加,让乙醇氧化成乙醛,两个乙醛分子生成CH3CH(OH)CH2CHO,将其氧化成CH3CH(OH)CH2COOH,再发生缩聚反应,其路线为
![]()
。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】一种通过铁基氧载体(Fe3O4/FeO)深度还原和再生来合成二甲醚(CH3OCH3) 的原理如图:
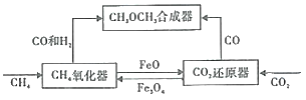
(1)二甲酸的合成反应:3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g);△H1
①已知CO、CH3OCH3与H2的燃烧热(△H)分别为 a kJ/mol、b kJ/mol、c kJ/mol(a、b、c均小于0),则△H1 ____kJ/moL。
②该反应选用(CuO/ZnO/Al2O)复合催化剂,该催化剂能_____(填标号)。
A.提高反应速率 B.促进平衡正向移动 C.改变反应的焓变 D.降低反应的活化能
(2)CH4氧化器中发生的主反应:
i.CH4(g)+Fe3O4(s)=CO(g)+2H2(g)+3FeO(s)
ii.CH4(g)+4Fe3O4(s)=CO2(g)+2H2O(g)+12FeO(s)
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如图。
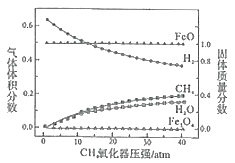
①随着压强的增大,反应i的平衡常数K值________(填“增大”、“减小”或“不变”)。
②结合图像,分析H2O的体积分数变化的原因________(用化学方程式表示)。
(3)将一定量的FeO 和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:CO2(g)+3FeO(s)=Fe3O4(s)+CO(g)。保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如下表。
温度t/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
①△H2______0(填“>”或“<”)。
②由上表可知,若在150℃时进行上述转化,理论转化率α(FeO)为100%。在上述反应体系中,一定可以说明该反应达到平衡状态的是______(填标号)。
A.CO2的物质的量不变
B.体系的压强不变
C.气体的平均摩尔质量不变
D.CO的生成速率和消耗速率相等且不等于零
③根据化学反应原理,分析CO2还原器温度设置在170℃的原因________。