题目内容
【题目】已知温度T时水的离子积常数为Kw,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.a=b
B.混合溶液中,c(H+)=![]() mol·L-1
mol·L-1
C.混合溶液的pH=7
D.混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-)
【答案】B
【解析】
A.a=b时,酸与碱刚好完全反应生成正盐,但酸与碱的强弱未知,所以溶液不一定呈中性,A不合题意;
B.混合溶液中,c(H+)=![]() mol·L-1= c(OH-),所以溶液呈中性,B符合题意;
mol·L-1= c(OH-),所以溶液呈中性,B符合题意;
C.温度不定,pH=7的溶液不一定呈中性,C不合题意;
D.c(H+)+ c(B+)= c(OH-)+ c(A-)只表示混合溶液中电荷守恒,不能肯定溶液呈酸性或碱性或中性,D不合题意;
故选B。

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
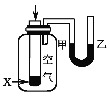
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )
反应装置或图像 | 实验现象或图像信息 | |
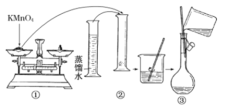
A |
| 反应开始后,针筒活塞向右移动 |
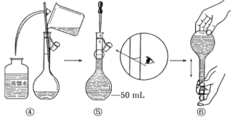
B |
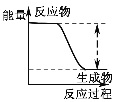
| 反应物总能量大于生成物总能量 |
C |
| 反应开始后,甲处液面低于乙处液面 |
D |
| 温度计的水银柱不断上升 |
A.AB.BC.CD.D