题目内容
【题目】研究燃料的燃烧效率和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g) = H2O(g) ![]() H= 242.0 kJ/mol
H= 242.0 kJ/mol
C(s)+1/2O2(g) = CO(g) ![]() H= 110.0 kJ/mol
H= 110.0 kJ/mol
①写出焦炭与水蒸气反应制H2和CO的热化学方程式_____________________。
②已知在101kPa时,CO、 H2和CH4的燃烧热分别为283kJ/mol、286 kJ/mol和892kJ/mol,H2O(l)= H2O(g) △H= +44.0 kJ/mol,则反应CH4(g)+ H2O(g) ![]() CO(g)+3H2(g)△H=______________。
CO(g)+3H2(g)△H=______________。
(2)已知一定温度和压强下,由H2和CO反应合成优质燃料甲醇:CO(g)+2H2(g)![]() CH3OH(g)△H=-91kJ/mo1
CH3OH(g)△H=-91kJ/mo1
①在相同条件下要想得到182kJ热量,加入各物质的物质的量可能是_____________。
A.2mo1 CO和4mol H2 B.2mo1 CO、4mol H2和1mol CH3OH(g)
C.4mo1 CO和4mol H2 D.4mo1 CO和6mol H2
②将1mol CO和2mol H2充入一密闭容器中,保持恒温恒压时进行反应,达到平衡时,测得CO的转化率为20%,反应达到平衡时的热量变化是___(填“吸收”或“放出”)___kJ热量。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 ①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2 ②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则 ΔH2=____。
【答案】C(s)+H2O(g)=CO(g)+H2(g) ![]() H=+132kJ/mol △H= +205kJ/mol D 放出 18.2 -1160 kJ·mol-1
H=+132kJ/mol △H= +205kJ/mol D 放出 18.2 -1160 kJ·mol-1
【解析】
(1)①已知:H2(g)+1/2O2(g)=H2O(g) △H1= 242.0kJ/mol ;C(s)+1/2O2(g)=CO(g) △H2= 110.0kJ/mol根据盖斯定律,用方程式2减去方程式1,可得:写出焦炭与水蒸气反应制H2和CO的热化学方程式 C(s)+H2O(g)=CO(g)+H2(g) △H=+132kJ/mol ;
②由题意知CO(g)+1/2O2(g)=CO2(g)△H1=﹣283kJ/mol;
H2 (g)+1/2O2(g)=H2O(l)△H2=﹣286kJ/mol;
CH4(g)+2O2(g)= CO2(g)+2H2O(l)△H3=﹣892kJ/mol
根据盖斯定律,CH4(g)+H2O(l)CO(g)+3H2(g)△H=△H3-△H1-3△H2=+249kJ/mol,又由于H2 (g)+1/2O2(g)=H2O(g)△H=﹣242.0kJ/mol;
H2 (g)+1/2O2(g)=H2O(l)△H=﹣286kJ/mol,
根据盖斯定律H2O(g)= H2O(l)△H=-44kJ/mol,
则CH4(g)+H2O(g)CO(g)+3H2(g)△H=+205kJ/mol。
(2)①由反应方程式可知生成1mol的CH3OH时放热91 kJ,想得到182 kJ热量,则需生成2molCH3OH;由于反应是可逆反应,不可能完全进行到底,所以要得到2molCH3OH,CO和H2物质的量必须要多于2mol和 4mol,故D符合,B选项中既有正反应又有逆反应,最终放出的热量小于182kJ,答案选D;
②将1mol CO和2mol H2充入一密闭容器中,保持恒温恒压时进行反应,达到平衡时,测得CO的转化率为20%,即消耗的CO为0.2mol,反应放出91kJ/mol×0.2mol=18.2kJ的热量;
(3) 1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则得反应③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH3=-867 kJ·mol-1;
已知①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1,
根据盖斯定律,由③×2-①得反应②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mol-1。

 学而优衔接教材南京大学出版社系列答案
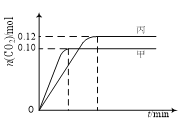
学而优衔接教材南京大学出版社系列答案【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的大
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%