题目内容
【题目】高温下,正硅酸锂(Li4SiO4)能与CO2发生反应,对控制CO2的排放具有重要的理论意义和实用价值。完成下列填空:
(1)硅原子核外电子占有_____种能量不同的轨道;Li、C、Si的最高价氧化物中,属于原子晶体的是_____。
(2)钠元素的金属性比锂强,用原子结构的知识说明理由_____。
一定温度下,在2L的密闭容器中,Li4SiO4与CO2发生如下反应:Li4SiO4(s)+CO2(g)![]() Li2SiO3(s)+Li2CO3(s)。
Li2SiO3(s)+Li2CO3(s)。
(3)该反应的平衡常数表达式K=_____,反应20min,测得容器内固体物质的质量增加了8.8g,则0~20min内CO2的平均反应速率为_____。
(4)在T1、T2温度下,恒容容器中c(CO2)随时间t的变化关系如图所示。该反应是_____反应(选填“放热”或“吸热”)。
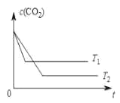
若T1温度下,达到平衡时c(CO2)为amol·L-1,保持其他条件不变,通入一定量的CO2,重新达到平衡时c(CO2)为bmol·L-1。试比较a、b的大小,并说明理由_____。
【答案】5 SiO2 钠元素和锂元素均为第ⅠA族元素,Na原子有3个电子层,Li原子有2个电子层,原子半径Na>Li,则原子核对外层电子的吸引能力:Na<Li,失电子能力:Na>Li,因此金属性Na强于Li ![]() 0.005mol·L-1·min-1 放热 a=b,通入一定量的CO2,平衡会正向进行,但由于温度不变,该反应的平衡常数K=
0.005mol·L-1·min-1 放热 a=b,通入一定量的CO2,平衡会正向进行,但由于温度不变,该反应的平衡常数K=![]() 不变,故达到新平衡时c(CO2)不变,即a=b
不变,故达到新平衡时c(CO2)不变,即a=b
【解析】
(1)硅是14号元素,基态硅原子的核外电子排布式为1s22s22p63s23p2,其核外电子共占有5种能量不同的轨道;Li、C、Si的最高价氧化物分别为Li2O、CO2、SiO2,Li2O是离子晶体、CO2是分子晶体、SiO2是原子晶体,故答案为:5;SiO2;
(2) 钠元素的金属性比锂强,从原子结构解释:钠元素和锂元素均为第ⅠA族元素,Na原子有3个电子层,Li原子有2个电子层,原子半径Na>Li,则原子核对外层电子的吸引能力:Na<Li,失电子能力:Na>Li,因此金属性Na强于Li,故答案为:钠元素和锂元素均为第ⅠA族元素,Na原子有3个电子层,Li原子有2个电子层,原子半径Na>Li,则原子核对外层电子的吸引能力:Na<Li,失电子能力:Na>Li,因此金属性Na强于Li;
(3)平衡常数等于生成物的平衡浓度幂之积除以反应物的平衡浓度幂之积,根据化学反应方程式Li4SiO4(s)+CO2(g)![]() Li2SiO3(s)+Li2CO3(s),反应物为气体的是二氧化碳,生成物均为固体,则平衡常数
Li2SiO3(s)+Li2CO3(s),反应物为气体的是二氧化碳,生成物均为固体,则平衡常数![]() ;反应中固体增加的质量即为消耗的CO2的质量,反应20min消耗的CO2的质量为8.8g,c(CO2)=8.8g÷44g/mol÷2L=0.1mol·L-1,则0~20min内CO2的平均反应速率
;反应中固体增加的质量即为消耗的CO2的质量,反应20min消耗的CO2的质量为8.8g,c(CO2)=8.8g÷44g/mol÷2L=0.1mol·L-1,则0~20min内CO2的平均反应速率![]() ,故答案为:
,故答案为:![]() ;0.005mol·L-1·min-1;
;0.005mol·L-1·min-1;
(4)由图像分析可知,T1先达到平衡,则温度T1>T2,T2到T1的过程是升温,c(CO2)增大,平衡逆向移动,则该反应是放热反应;若T1温度下,达到平衡时c(CO2)为amol·L-1,保持其他条件不变,通入一定量的CO2,平衡会正向进行,但由于温度不变,该反应的平衡常数K=![]() 不变,故达到新平衡时c(CO2)不变,即a=b,故答案为:放热;a=b,通入一定量的CO2,平衡会正向进行,但由于温度不变,该反应的平衡常数K=
不变,故达到新平衡时c(CO2)不变,即a=b,故答案为:放热;a=b,通入一定量的CO2,平衡会正向进行,但由于温度不变,该反应的平衡常数K=![]() 不变,故达到新平衡时c(CO2)不变,即a=b。
不变,故达到新平衡时c(CO2)不变,即a=b。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案