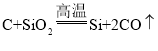题目内容
【题目】室温下,将稀盐酸滴加到某0.01mol/L一元弱碱(BOH)溶液中,测得混合溶液的pOH与离子浓度的变化关系如图所示。下列叙述错误的是( )
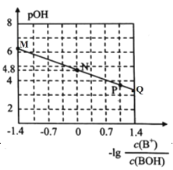
A.BOH的电离常数Kb的数量级为10-5
B.M点所示的溶液中:![]()
C.P点表示未加入稀盐酸的溶液
D.N点所示的溶液中:![]()
【答案】C
【解析】
A.一元弱碱(BOH)溶液中,BOHB++OH-,则电离常数Kb=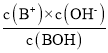 ,可得-lg
,可得-lg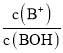 =-lg
=-lg![]() =- lgKb+ lgc(OH-)=-lgKb-pOH,代入N点数据,0=- lgKb-4.8,Kb=10-4.8,则Kb数量级为10-5,故A正确;
=- lgKb+ lgc(OH-)=-lgKb-pOH,代入N点数据,0=- lgKb-4.8,Kb=10-4.8,则Kb数量级为10-5,故A正确;
B.常温下,M点所示的溶液中存在电荷守恒:c(Cl-)+c(OH-)=c(H+)+c(B+),且pOH=6,则pH=14- pOH =8,溶液显碱性,c(OH-)>c(H+),则c(Cl-)<c(B+),故B正确;
C.根据图示,结合A项分析,P点,-lg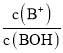 =-lgKb-pOH=1.05,则pOH=-lgKb+1.05=4.8-1.05=3.75,与图示不符,则P点不表示未加入稀盐酸的溶液,故C错误;
=-lgKb-pOH=1.05,则pOH=-lgKb+1.05=4.8-1.05=3.75,与图示不符,则P点不表示未加入稀盐酸的溶液,故C错误;
D.N点-lg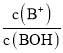 =0,则c(B+)= c(BOH),根据电荷守恒:c(Cl-)+c(OH-)=c(H+)+c(B+),则可变为:c(Cl-)+c(OH-)=c(H+)+ c(BOH),故D正确;
=0,则c(B+)= c(BOH),根据电荷守恒:c(Cl-)+c(OH-)=c(H+)+c(B+),则可变为:c(Cl-)+c(OH-)=c(H+)+ c(BOH),故D正确;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】一定温度下,向![]() 溶液中加入适量
溶液中加入适量![]() 溶液,不同时刻测得生成
溶液,不同时刻测得生成![]() 的体积(已折算为标准状况)如下表所示。资料显示,反应分两步进行:①
的体积(已折算为标准状况)如下表所示。资料显示,反应分两步进行:①![]() ,②
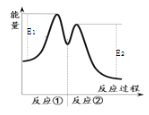
,②![]() ,反应过程中能量变化如下图所示。下列说法正确的是( )
,反应过程中能量变化如下图所示。下列说法正确的是( )
t/min | 0 | 3 | 6 | 10 |
V(O2)/mL | 0 | 9.9 | 17.2 | 22.4 |
A.![]() 是该反应过程的催化剂
是该反应过程的催化剂
B.0~10 min的平均反应速率:![]()
C.反应![]() 在无催化剂时的活化能为E1
在无催化剂时的活化能为E1
D.反应![]() 的
的![]()
【题目】某同学进行下列实验:
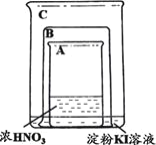
装置 | 操作 | 现象 |
| 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住。 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色。 |
下列说法不合理的是
A.烧杯A中发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
B.红棕色气体消失可能与NO2和烧杯C中的KI发生反应有关
C.烧杯A中溶液变蓝是因为产生了Cu(NO3)2
D.若将铜片换成铁片,则C中的液体不会变蓝