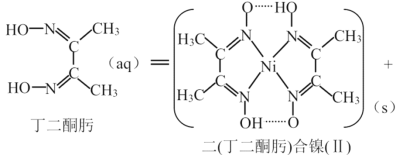
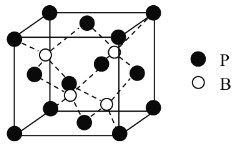
题目内容
【题目】以下事实不能用元素周期律解释的是( )
A.向![]() 溶液中通入氧气后生成浅黄色沉淀
溶液中通入氧气后生成浅黄色沉淀
B.氯与钠形成离子键,氯与硅形成共价键
C.工业生产硅单质原理: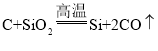
D.Na与冷水反应剧烈,Mg与冷水反应缓慢
【答案】C
【解析】
A.向![]() 溶液中通入氧气后生成浅黄色硫沉淀,反应中O2是氧化剂,S是氧化产物,氧化性:O2>S,O、S位于同主族,从上到下,非金属性减弱,非金属性越强,对应单质的氧化性越强,故A可以用元素周期律解释;
溶液中通入氧气后生成浅黄色硫沉淀,反应中O2是氧化剂,S是氧化产物,氧化性:O2>S,O、S位于同主族,从上到下,非金属性减弱,非金属性越强,对应单质的氧化性越强,故A可以用元素周期律解释;
B.Na、Si位于同周期,从左向右金属性减弱、非金属性增强,Na易失去电子,则氯与钠形成离子键,Si不易失去电子,氯与硅形成共价键,故B可用元素周期律解释;
C.C、Si位于同主族,从上到下,非金属性减弱,对应单质的氧化性逐渐减弱,工业生产硅单质原理: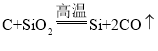 反应中C是还原剂,Si是还原产物,还原性C>Si,不能比较单质的氧化性强弱,故C不能用元素周期律解释;
反应中C是还原剂,Si是还原产物,还原性C>Si,不能比较单质的氧化性强弱,故C不能用元素周期律解释;
D.Na、Mg位于同周期,从左向右金属性减弱、非金属性增强,金属性:Na>Mg,元素金属性越强,对应单质与水反应越剧烈,故D能用元素周期律解释;
答案选C。

 期末集结号系列答案
期末集结号系列答案【题目】用如图所示的装置进行实验,仪器![]() 、
、![]() 、
、![]() 中分别盛有试剂1、2、3,其中能达到实验目的是( )
中分别盛有试剂1、2、3,其中能达到实验目的是( )
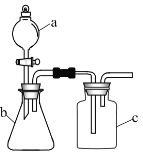
选项 | 试剂1 | 试剂2 | 试剂3 | 实验目的 |
A | 浓盐酸 |
| 饱和食盐水 | 制备 |
B | 浓硫酸 | 乙醇 | 溴水 | 验证乙烯能使溴水褪色 |
C | 盐酸 |
| 品红试液 | 证明 |
D | 稀硫酸 | 溶液 | 澄清石灰水 | 验证 |
A.AB.BC.CD.D
【题目】三氯氧磷(POCl3)是一种工业化工原料,可用于制取有机磷农药、长效磺胺药物等,还可用作染料中间体、有机合成的氯化剂和催化剂、阻燃剂等。利用O2和PCl3为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
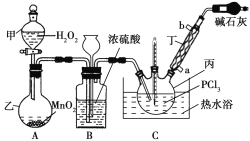
已知PCl3和三氯氧磷的性质如表:
熔点/℃ | 沸点/℃ | 其他物理或化学性质 | |
PCl3 | -112.0 | 76.0 | PCl3和POCl3互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和HCl |
POCl3 | 1.25 | 106.0 |
(1)装置A中的分液漏斗能否用长颈漏斗代替?做出判断并分析原因:_______
(2)装置B的作用是______________(填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压
(3)仪器丙的名称是___________,实验过程中仪器丁的进水口为__________(填“a”或“b”)口。
(4)写出装置C中发生反应的化学方程式_______,该装置中用温度计控制温度为60~65 ℃,原因是________。
(5)称取16.73 g POCl3样品,配制成100 mL溶液;取10.00 mL溶液于锥形瓶中,加入3.2 mol·L-1的AgNO3溶液10.00 mL,并往锥形瓶中滴入5滴Fe2(SO4)3溶液;用0.20 mol·L-1的KSCN溶液滴定,达到滴定终点时消耗KSCN溶液10.00 mL(已知:Ag++SCN-=AgSCN↓)。则加入Fe2(SO4)3溶液的作用是________,样品中POCl3的纯度为_____________。